云舟生物科技(广州)股份有限公司品牌商
8 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
BAC-AAV 病毒载体知多少?
4370 人阅读发布时间:2020-12-24 17:12
载体家Bac-AAV嵌合病毒载体上线啦!
重组AAV(rAAV)病毒由于其对宿主基因组的非整合性、广泛的宿主细胞范围、多样的组织嗜性、低免疫原性和体内外源基因表达时间长等特点,特别适用于疫苗和基因治疗药物开发,也是当今治疗多种基因缺陷疾病常用的病毒载体。
生产重组AAV有多种方式,目前应用的有质粒共转、Ad-AAV、HSV-AAV、Bac-AAV等生产系统。实验室传统的三质粒共转染哺乳动物细胞的方式由于机制和成本上的限制,已经不能满足临床试验和注射大型动物所需要的高剂量要求。使用腺病毒(Ad)、单纯疱疹病毒(HSV)作为辅助病毒包装AAV,由于辅助病毒能够感染人类,因此也不适合用于临床试验。为了实现更大规模的、更安全的AAV生产,采用昆虫细胞表达系统来包装AAV是更好的选择。结合Sf9细胞可以大量表达重组蛋白的特点,使用含有rAAV 基因组以及rAAV Rep/Cap基因的昆虫杆状病毒转导Sf9细胞,让AAV在Sf9细胞中组装,最终生产规模可达到50,000活性病毒颗粒/每细胞(Urabe, Masashi et al., 2002)。已经上市的基因治疗药物Glybera,便是采用的Bac-AAV系统生产的。
1. Sf9细胞可以悬浮培养,比如在200L的大型生物反应器中培养,比贴壁细胞具有更高的培养密度,有助于提升病毒产量。此外使用生物反应器培养也更容易满足GMP质量要求。
2. Sf9细胞培养不使用血清,从而避免引入动物源性成分,在生物安全性上更完善。同时,血清的减少使用也带来了更低的培养基成本,有助于提升培养规模。
3. 残留的杆状病毒组分不会在人体内进行复制,对比质粒转染、Ad-AAV、HSV-AAV等扩增方式残留的辅助病毒组分更加安全。
一个经典的Bac-AAV包装流程如下图所示:
首先在杆状病毒载体骨架的Tn7转座子之间区域上分别引入AAV基因和包装质粒组分,形成rBac-Rep、rBac-Cap和含有目的基因(GOI)的三种pBac载体。将这些pBac载体转化表达有Tn7转座酶的E. coli, 此时pBac载体上Tn7转座子之间的区域整合进Bacmid。提取这些重组后的Bacmid用以转染Sf9细胞,可分别获得包含Rep、Cap和目的基因的三种类型的杆状病毒。使用这些杆状病毒共转导更多的Sf9细胞:Sf9细胞以表达重组蛋白的方式表达AAV组分,并包装形成完整的rAAV病毒颗粒。
载体家已经上线定制化的Bac-AAV嵌合病毒载体,可选择广泛性启动子、组织特异性启动子或诱导型启动子驱动自定义ORF表达。载体家使用Bac-AAV载体生产的多种血清型的AAV在293T细胞中进行了测试,取得了良好的转导效果:
重组AAV(rAAV)病毒由于其对宿主基因组的非整合性、广泛的宿主细胞范围、多样的组织嗜性、低免疫原性和体内外源基因表达时间长等特点,特别适用于疫苗和基因治疗药物开发,也是当今治疗多种基因缺陷疾病常用的病毒载体。
生产重组AAV有多种方式,目前应用的有质粒共转、Ad-AAV、HSV-AAV、Bac-AAV等生产系统。实验室传统的三质粒共转染哺乳动物细胞的方式由于机制和成本上的限制,已经不能满足临床试验和注射大型动物所需要的高剂量要求。使用腺病毒(Ad)、单纯疱疹病毒(HSV)作为辅助病毒包装AAV,由于辅助病毒能够感染人类,因此也不适合用于临床试验。为了实现更大规模的、更安全的AAV生产,采用昆虫细胞表达系统来包装AAV是更好的选择。结合Sf9细胞可以大量表达重组蛋白的特点,使用含有rAAV 基因组以及rAAV Rep/Cap基因的昆虫杆状病毒转导Sf9细胞,让AAV在Sf9细胞中组装,最终生产规模可达到50,000活性病毒颗粒/每细胞(Urabe, Masashi et al., 2002)。已经上市的基因治疗药物Glybera,便是采用的Bac-AAV系统生产的。

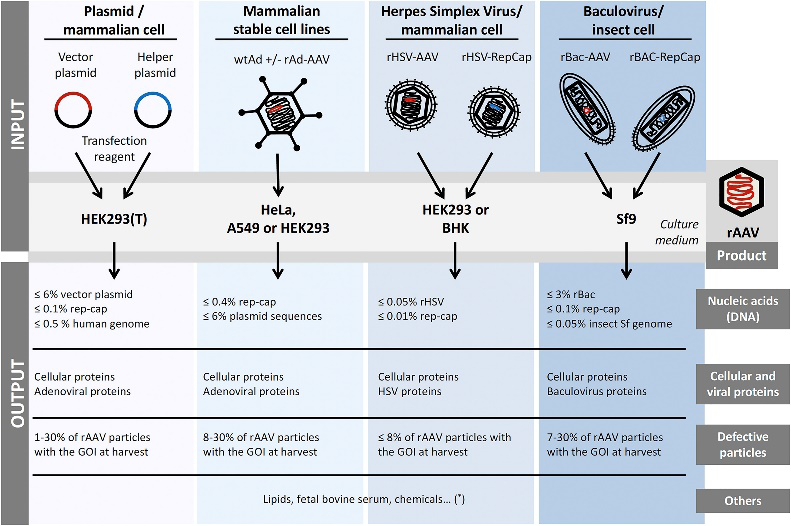
图1 重组AAV的生产方式比较
(Penaud-Budloo, et al, 2018)
利用昆虫Sf9细胞生产AAV的优点是显而易见的:1. Sf9细胞可以悬浮培养,比如在200L的大型生物反应器中培养,比贴壁细胞具有更高的培养密度,有助于提升病毒产量。此外使用生物反应器培养也更容易满足GMP质量要求。
2. Sf9细胞培养不使用血清,从而避免引入动物源性成分,在生物安全性上更完善。同时,血清的减少使用也带来了更低的培养基成本,有助于提升培养规模。
3. 残留的杆状病毒组分不会在人体内进行复制,对比质粒转染、Ad-AAV、HSV-AAV等扩增方式残留的辅助病毒组分更加安全。
一个经典的Bac-AAV包装流程如下图所示:


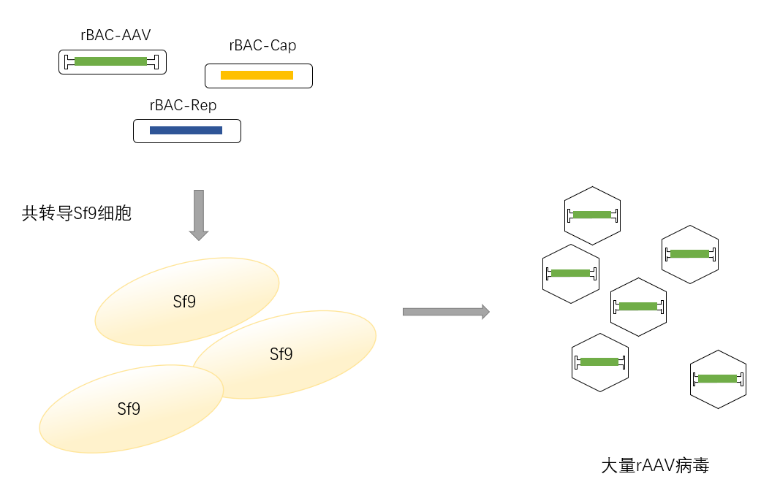
图2 Bac-AAV的包装流程
首先在杆状病毒载体骨架的Tn7转座子之间区域上分别引入AAV基因和包装质粒组分,形成rBac-Rep、rBac-Cap和含有目的基因(GOI)的三种pBac载体。将这些pBac载体转化表达有Tn7转座酶的E. coli, 此时pBac载体上Tn7转座子之间的区域整合进Bacmid。提取这些重组后的Bacmid用以转染Sf9细胞,可分别获得包含Rep、Cap和目的基因的三种类型的杆状病毒。使用这些杆状病毒共转导更多的Sf9细胞:Sf9细胞以表达重组蛋白的方式表达AAV组分,并包装形成完整的rAAV病毒颗粒。
载体家已经上线定制化的Bac-AAV嵌合病毒载体,可选择广泛性启动子、组织特异性启动子或诱导型启动子驱动自定义ORF表达。载体家使用Bac-AAV载体生产的多种血清型的AAV在293T细胞中进行了测试,取得了良好的转导效果:

图3 利用Bac-AAV系统生产的AAV转导293T细胞。转导后后48小时拍摄细胞,荧光曝光时间30ms。
云舟生物科技(广州)有限公司
020-28069042
service@vectorbuilder.cn
www.vectorbuilder.cn