云舟生物科技(广州)股份有限公司品牌商
8 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
载体家小课堂 | 嵌合抗原受体(CAR)基因递送
3280 人阅读发布时间:2021-10-29 16:14

CAR T细胞疗法通过基因工程获得特异性识别并杀伤肿瘤细胞的T淋巴细胞,现已成为一种极具发展前景的肿瘤治疗手段。制备CAR T细胞首先从患者自体或者捐赠者同种异体的血液中富集T细胞,向其提供激活其细胞分裂的分子信号,然后再通过基因工程引入特异性识别肿瘤的嵌合抗原受体(Chimeric antigen receptor,CAR)。这种在T细胞表面表达的人工受体强化了T细胞特异性识别并杀伤肿瘤细胞的能力。最后这些改造过后的T细胞被扩增至足够数量,以便回输至患者体内实现肿瘤治疗目的[1]。
自1993年Eshar等人开发第一代CAR以来,CAR的基本结构可看成由四个部分构成[2]:
- 抗原识别结构域(Ligand-binding domain),位于胞外,多数采用已知特异性的抗体的单链可变区片段 (Single chain variable fragment,scFv) 。一个合适的scFV需要针对肿瘤细胞表面受体表现出足够的亲和性,同时不会靶向正常细胞发生脱靶效应。
- 铰链区(Hinge),将scFv与CAR的跨膜结构域连接起来,为CAR的胞外结构提供灵活性和稳定性。其中CD8和CD28 hinge已经用于被临床允许的CAR T细胞的CAR设计中。
- 跨膜结构域(Transmembrane domain,TM),将CAR锚定在质膜上,从而将胞外的的CAR结构同细胞内的结构连接起来。
- 胞内信号域(Cytoplasmic domain),通常使用T细胞受体的CD3 ζ链。在二代CAR中,还引入一个共刺激结构域(Costimulatory domain)被串联到CD3 ζ结构上,有助于增强T细胞的增殖能力和活化的持久性。
病毒载体
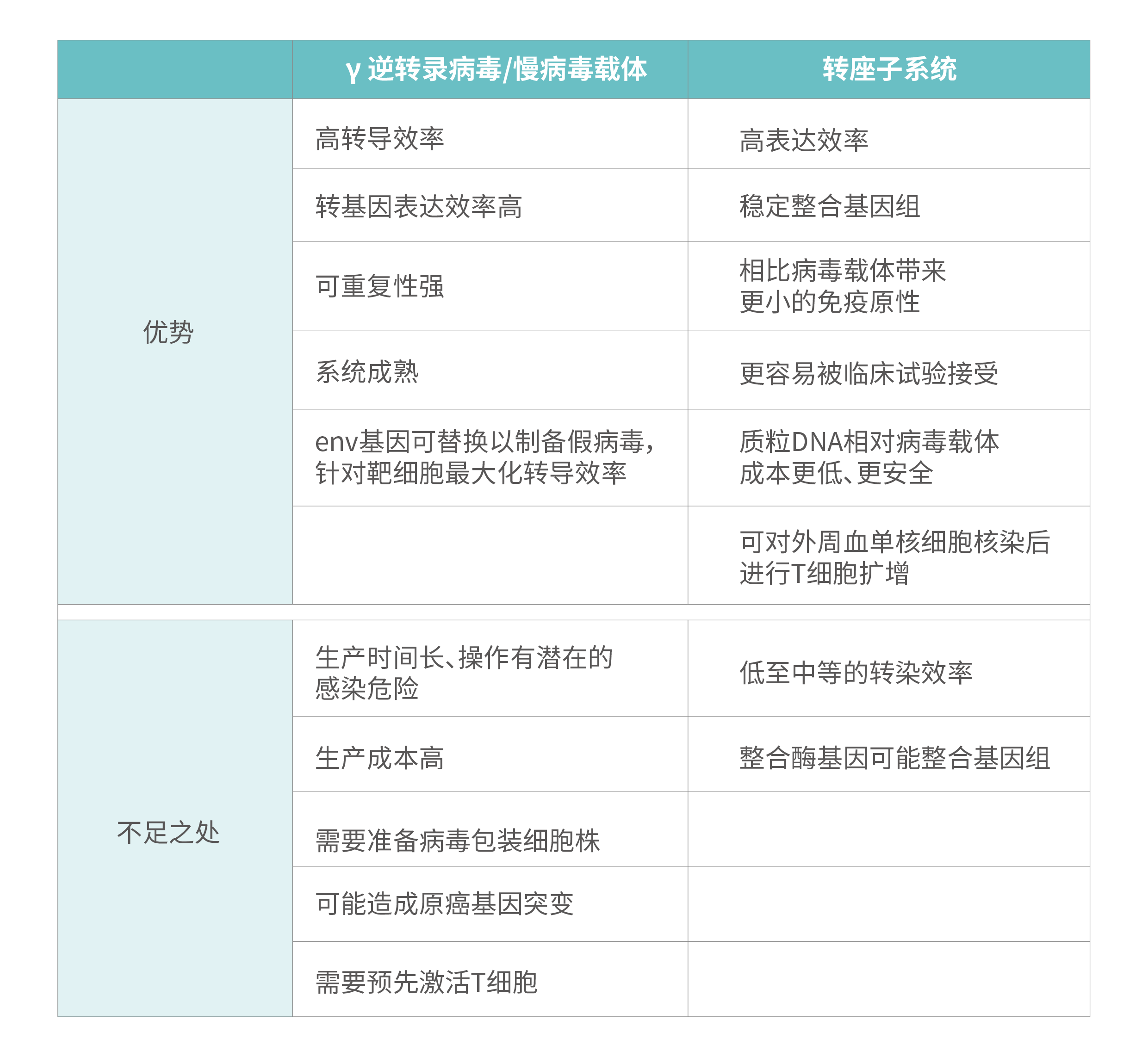
向T细胞引入CAR需要使用携带CAR表达盒的基因递送载体,而历史上相当多的CAR T研究均使用γ逆转录病毒作为CAR递送载体[4]。逆转录病毒转导T细胞后,病毒基因组上的两个长末端重复序列(Long terminal repeat,LTR)之间的CAR表达盒随机整合至宿主细胞基因组,从而实现CAR的长期稳定表达。当前同属逆转录病毒科(Retroviridae)的慢病毒则是一种转导效率和安全性更优的病毒载体。使用VSV-G替换env膜蛋白的慢病毒具有广泛的细胞嗜性。慢病毒与γ逆转录病毒不同,病毒RNA逆转录成双链DNA后可以穿过核膜进入细胞核,因此具备感染非分裂细胞的能力。在第三代慢病毒载体中,其5' LTR的启动子是自失活的,并且允许使用者自定义启动子驱动CAR表达。这相对于γ逆转录病毒只能依赖自身5' LTR启动子驱动CAR表达也是一个额外的优势。
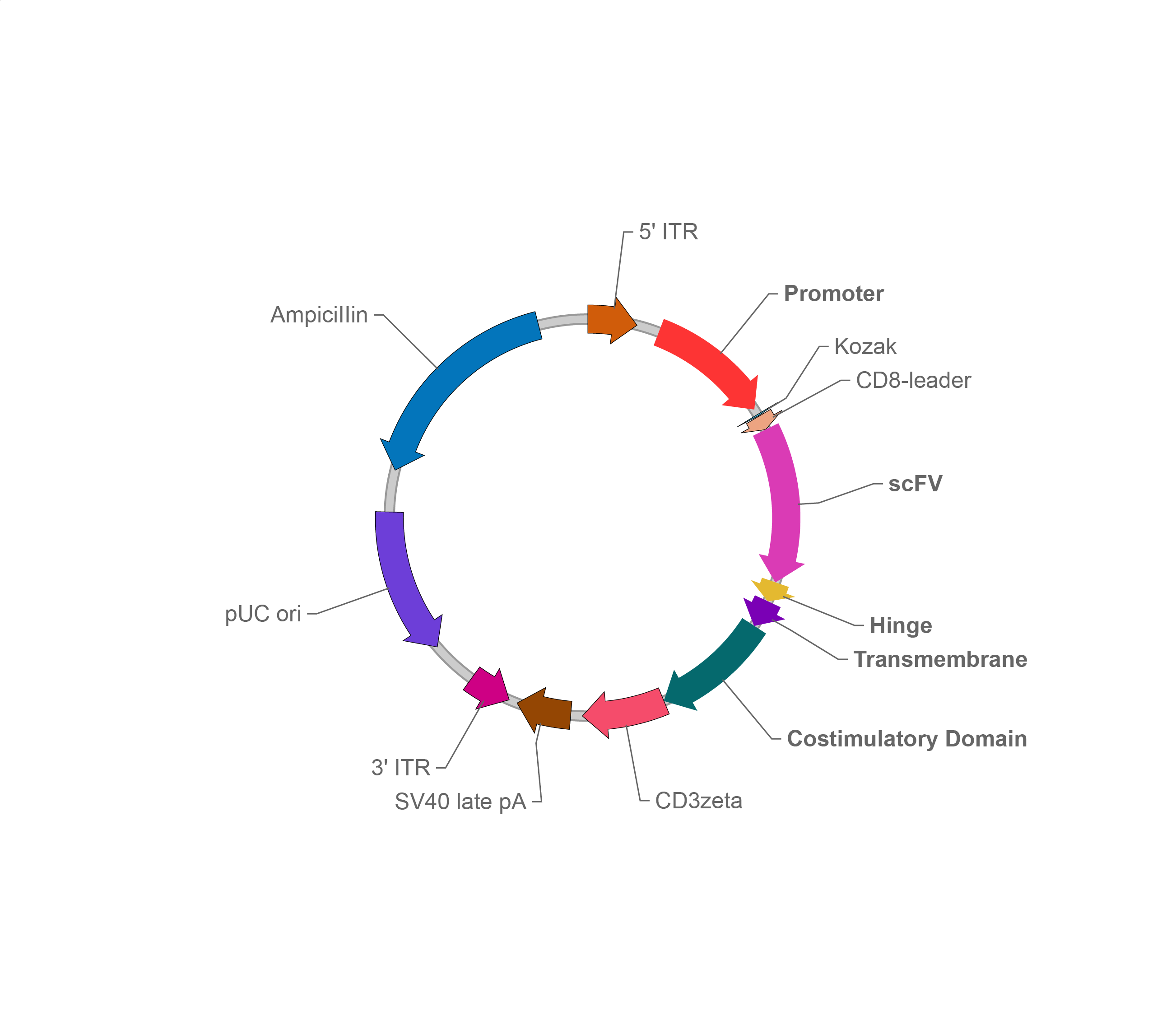
载体家CAR表达慢病毒载体
尽管病毒载体在转导细胞时表现出很高的转导效率,然而当前利用逆转录病毒载体制备CAR细胞在实际应用时仍保留有以下问题:
- 随机整合现象带来原癌基因突变和基因毒性等风险,不利于临床应用。为此有研究则尝试使用非整合型慢病毒进行CAR递送[5]。
- 病毒载体在cGMP实验室受到大量严格的规范限制。
- 病毒载体可携带的基因大小较为受限,例如野生型的慢病毒基因组大小约为9.2 kb,当使用者的目的序列加上病毒包装、转导所需的元件序列的总大小若超出此限制时,会对病毒包装效率产生不良影响。
- 病毒载体自身组分带来潜在的免疫原性问题。
- GMP级别病毒的大规模生产成本高昂。对于这些问题,业界认为性价比更高的非病毒载体是今后用于CAR T细胞制备的一个不可或缺的选择[6]。
非病毒载体:转座子系统
具备转座子机制的质粒DNA相当适合作为CAR递送的非病毒载体。尽管以电转法将质粒导入细胞在规模化放大上有一定困难,目前仍有多种转座子系统被报道用于生产CAR T细胞 [7]:
睡美人(Sleeping beauty,SB)转座子系统
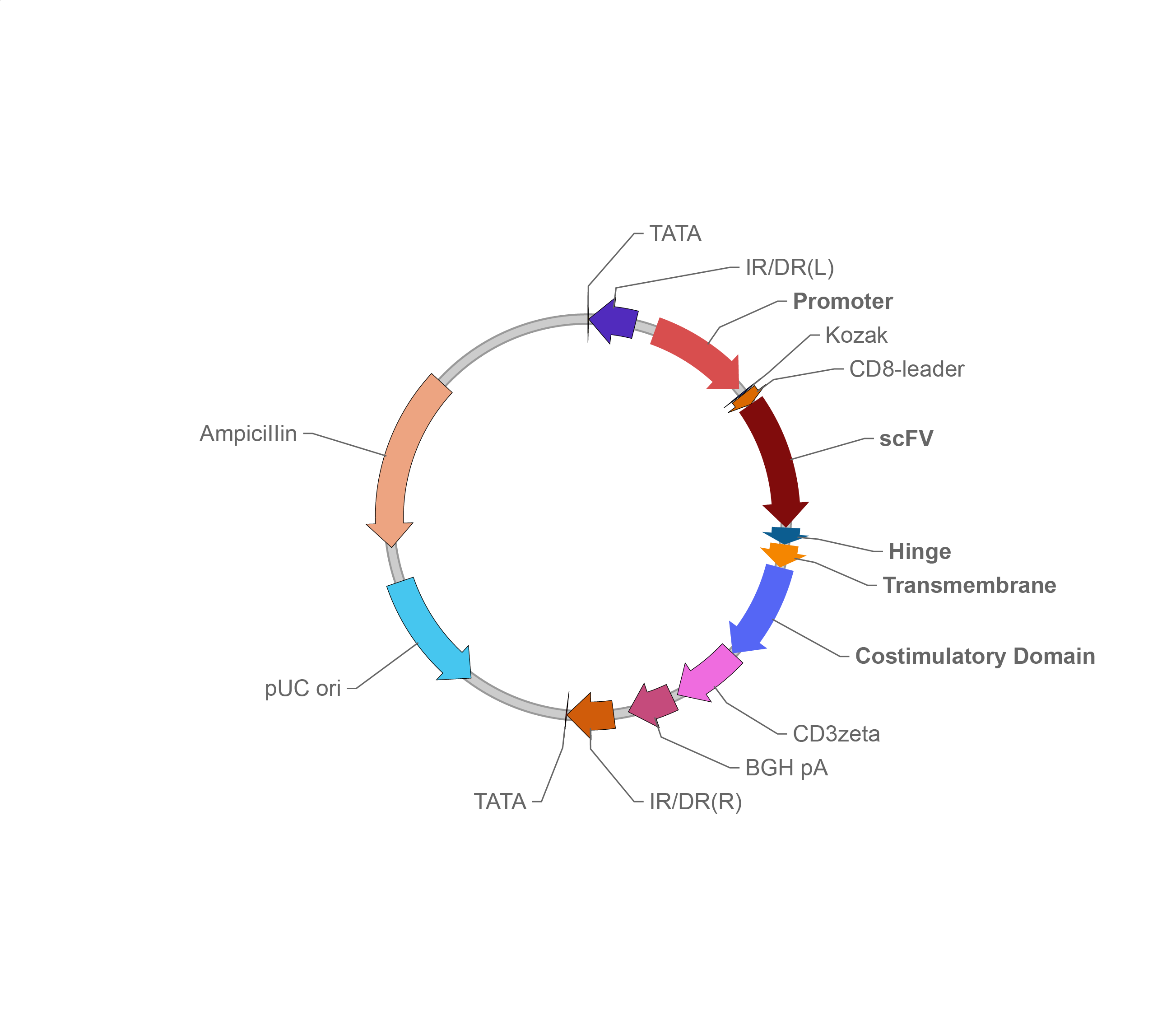
载体家CAR表达Sleeping beauty载体
睡美人转座子来源于鱼类Tc1/mariner转座子超家族,移除了鲑鱼基因组的Tc1/mariner转座子上的失活突变,重新构筑出有使用价值的带有活性的转座子。使用SB系统在操作上十分简洁,仅需向细胞转染一个编码转座酶的辅助质粒和一个含有目的基因的转座子质粒。当辅助质粒和转座子质粒共转染至靶细胞时,辅助质粒表达的转座酶会识别转座子质粒上的两个反向/正向重复序列(Inverted/direct repeat sequence,IR/DR)序列,然后将两个IR/DR序列之间的目的基因区域作为转座子插入宿主基因组上的TA二核苷酸位点。Monjezi等人分析了SB系统与传统慢病毒方式在T细胞基因组的CAR序列插入分布,发现SB系统在基因组中表现出更高的整合效率,而且倾向在表达外源基因的安全位点(Safe harbor)发生整合,避免突变高表达基因和癌相关基因[8]。
Tol2转座子系统
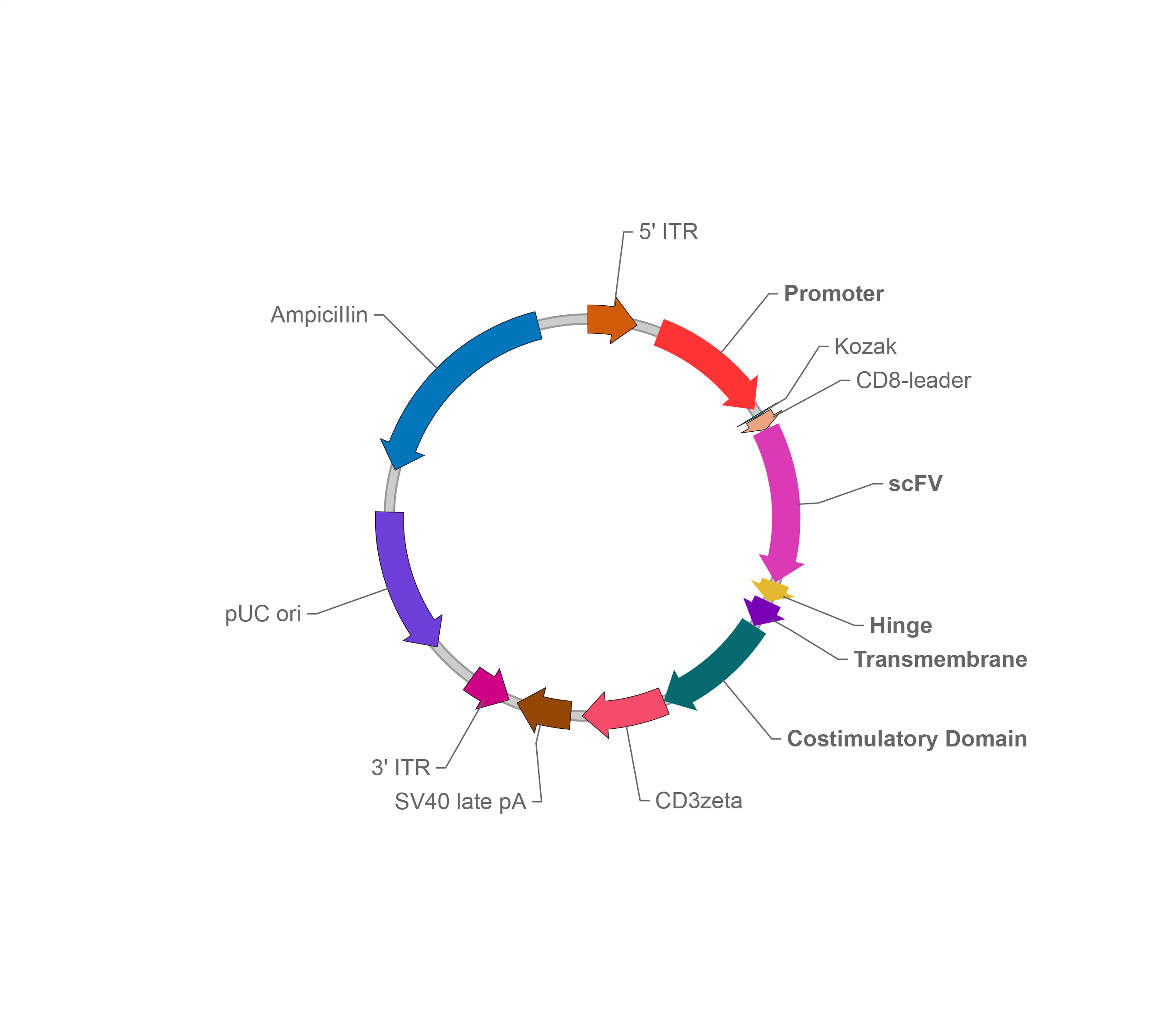
载体家CAR表达Tol2载体
To2转座子同样可用于CAR的递送。使用Tol2系统需要两个载体,一个是负责编码转座酶的辅助质粒,另一个是携带CAR序列的转座子质粒,CAR序列位于两个反向末端重复序列(Inverted terminal repeat,ITR)之间的转座区域。当使用辅助质粒和转座子质粒共转染靶细胞时,辅助质粒产生的转座酶将会识别转座子的两个ITR,然后以“剪切-粘贴”机制将转座区域和两个ITR元件插入到宿主基因组中。对比SB系统的TA插入位点,Tol2转座子在宿主细胞中的插入位点似乎是随机的,但是可以携带更大的基因进行转座。
PiggyBac转座子系统
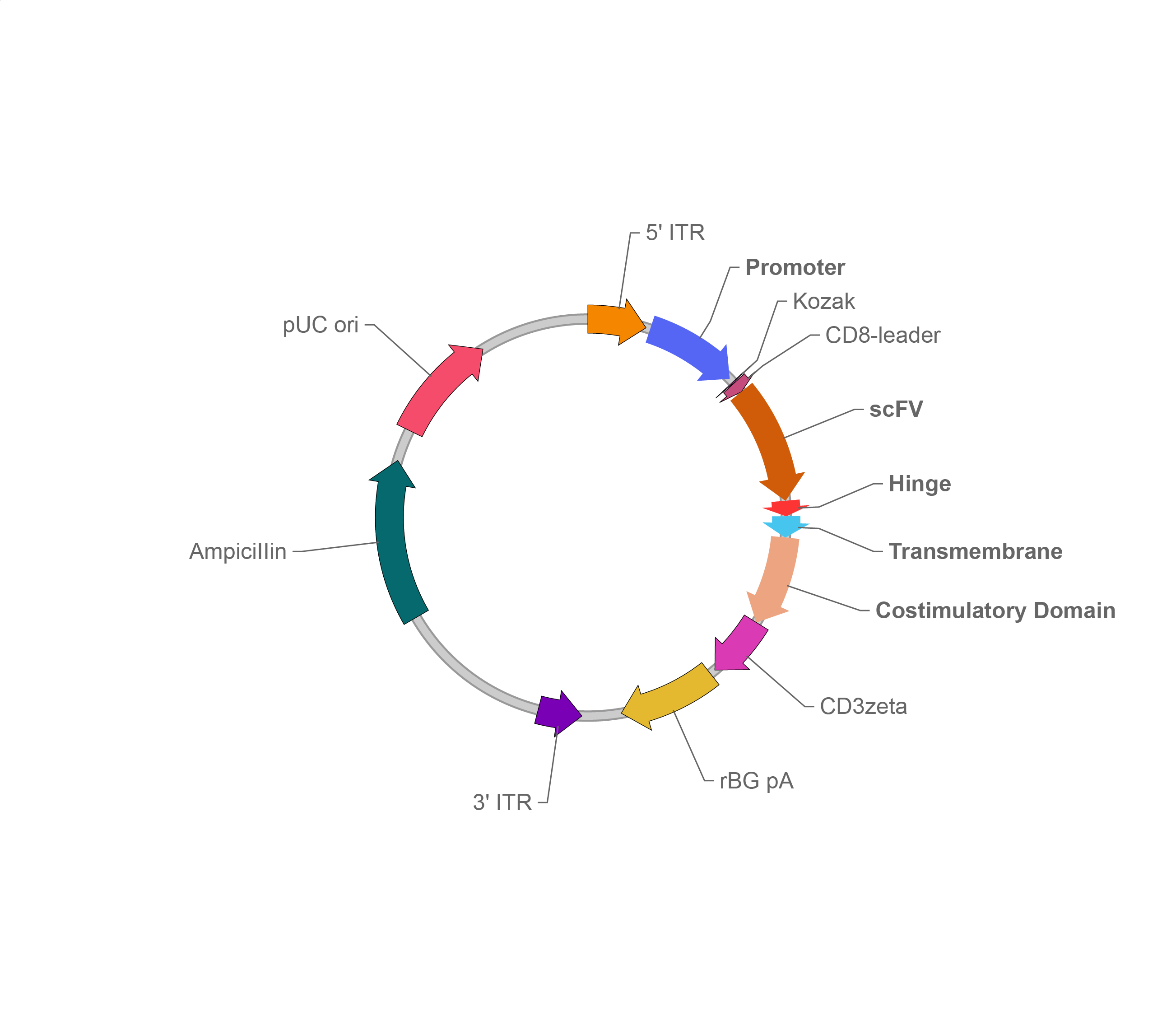
载体家CAR表达piggyBac载体
PiggyBac转座子系统是SB转座子系统的最大竞争者。piggyBac转座子最初从粉纹夜蛾(Trichoplusia ni)中发现并分离出来,使用该系统同样仅需一个是编码PBase转座酶的辅助质粒/mRNA和一个是携带CAR序列的转座子质粒,其中CAR序列位于转座子质粒的两个ITR区域之间。与SB和Tol2转座子类似,piggyBac转座子同样遵循“剪切-粘贴”的转座机制,但是在基因组上的插入位点为TTAA。piggyBac系统允许拥有相当大的载体容量,载体家构建的转座子载体总容量可达30 kb。
病毒载体与转座子系统用于CAR T细胞制备上的比较[9]:
非病毒载体:体外转录的mRNA
近年来使用体外转录的mRNA(In vitro transcribed mRNA,IVT mRNA)递送CAR被认为相对质粒转染法更具优势。质粒进入细胞后存在一个关键问题,即质粒DNA难以穿过核膜,导致其在非分裂细胞中的成功转染效率很低。使用mRNA可以有效避免这种问题,尽管体外转录mRNA为保证mRNA稳定性上要求更高的生产工艺。IVT mRNA的另一个优势是,mRNA对比质粒的表达效率更高,且更安全。mRNA进入细胞后可以直接开始翻译,并且随着时间推移将被宿主细胞降解,大为减少了任何插入突变的风险。一个典型的二代CAR的IVT mRNA结构如下[10]:
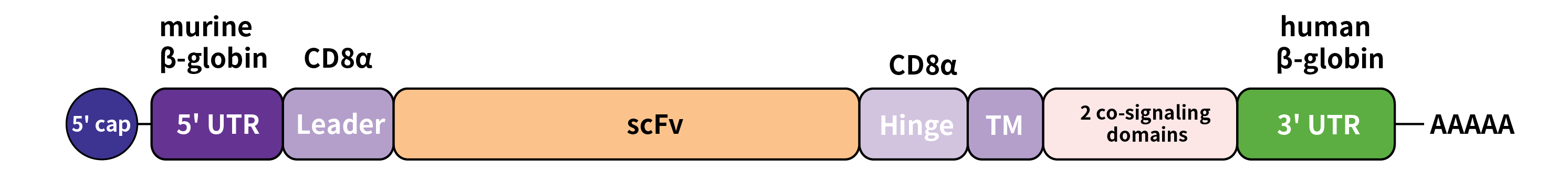
载体家提供全方位的IVT mRNA合成服务,合成的mRNA长度可达10 kb以上。我们的mRNA分子可针对于不同应用场景进行优化定制,包括添加5’ m7G帽子和3’ polyA尾巴、密码子优化等,有利于增强mRNA的稳定性和翻译效率。mRNA分子还可以进行核苷修饰、转录后修饰及柱纯化等一系列特定工艺流程,以进一步满足下游应用需求。
点击此处了解载体家IVT mRNA定制服务详情
参考文献
[1] Vormittag P, Gunn R, Ghorashian S, Veraitch FS. A guide to manufacturing CAR T cell therapies. Curr Opin Biotechnol. 2018;53:164-181.
[2] Jayaraman J, Mellody MP, Hou AJ, et al. CAR-T design: Elements and their synergistic function. EBioMedicine. 2020;58:102931.
[3] https://www.fda.gov/vaccines-blood-biologics/cellular-gene-therapy-products/approved-cellular-and-gene-therapy-products
[4] Sadelain M, Brentjens R, Rivière I. The basic principles of chimeric antigen receptor design. Cancer Discov. 2013;3(4):388-398.
[5] Jin C, Fotaki G, Ramachandran M, Nilsson B, Essand M, Yu D. Safe engineering of CAR T cells for adoptive cell therapy of cancer using long-term episomal gene transfer. EMBO Mol Med. 2016;8(7):702-711.
[6] Atsavapranee ES, Billingsley MM, Mitchell MJ. Delivery technologies for T cell gene editing: Applications in cancer immunotherapy. EBioMedicine. 2021;67:103354. doi:10.1016/j.ebiom.2021.103354
[7] Lukjanov V, Koutná I, Šimara P. CAR T-Cell Production Using Nonviral Approaches. J Immunol Res. 2021;2021:6644685.
[8] Monjezi R, Miskey C, Gogishvili T, et al. Enhanced CAR T-cell engineering using non-viral Sleeping Beauty transposition from minicircle vectors. Leukemia. 2017;31(1):186-194.
[9] D'Aloia MM, Zizzari IG, Sacchetti B, Pierelli L, Alimandi M. CAR-T cells: the long and winding road to solid tumors. Cell Death Dis. 2018;9(3):282. Published 2018 Feb 15.
[10] Miliotou AN, Papadopoulou LC. In Vitro-Transcribed (IVT)-mRNA CAR Therapy Development [published correction appears in Methods Mol Biol. 2020;2086:C1]. Methods Mol Biol. 2020;2086:87-117.
云舟生物科技(广州)有限公司
网址:www.vectorbuilder.cn
电话:020-28069042
邮箱:service@vectorbuilder.cn