云舟生物科技(广州)股份有限公司品牌商
8 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
载体家小课堂 | CRISPR基因编辑原理
2690 人阅读发布时间:2022-08-31 17:30
CRISPR/Cas9表达载体是一种对基因组的靶位点快速有效地产生突变的基因编辑系统。这些载体编码的特异性RNA,能够引导DNA核酸酶或缺刻酶编辑基因组中特定位点的DNA序列。CRISPR/Cas9技术源于原核生物的天然免疫系统CRISPR/Cas。在自然界中,细菌利用CRISPR/Cas抵抗质粒和噬菌体等外源遗传物质的入侵,从而保持自身基因组的完整性。
了解Cas9蛋白
CRISPR/Cas9基因编辑系统由Cas9蛋白和gRNA(guide RNA)组成。在细胞内,Cas9蛋白与gRNA形成复合物,能特异性鉴别出靶序列。此过程中,Cas9蛋白负责将复合物定点到靶DNA和剪切靶DNA。Cas9蛋白有6个结构域,分别是Rec I、Rec II、桥螺旋(Bridge Helix)、PAM互作结构域(PAM Interacting)、HNH和RuvC。Rec I是6个中最大的一个结构域,负责结合gRNA。一旦结合了靶DNA,桥螺旋就负责启动剪切。PAM互作结构域赋予Cas9对PAM序列的特异性要求,负责启动与靶DNA的结合。HNH和RuvC都是核酸酶结构域,负责对DNA执行剪切。

CRISPR/Cas9介导的基因编辑
云舟生物的CRISPR/Cas9表达载体中有两种Cas9供选择。最常用的Cas9是从Streptococcus pyogenes细菌中通过基因工程获得的(又名SpCas9或hCas9),可在靶位点产生DNA双链断裂 (Double strands DNA break,DSB)。另一种广泛使用的Cas9变体,即具有“切口酶”性质的Cas9,比如Cas9(D10A),可对DNA单链进行切割。如果将Cas9切口酶与两个gRNA同时使用,并且两个gRNA分别靶向位于单个目标区域两侧的两条相反DNA链,则切口酶将在每条链上产生一个单链切口,从而导致目标区域发生DSB。一旦通过CRISPR系统产生DSB,细胞就会激活非同源末端连接 (Non-homologous End Joining-NHEJ,NHEJ) 途径来修复DNA断裂,这通常会导致少量碱基的随机缺失,或者发生更罕见的碱基插入和碱基替换等突变。当这些突变破坏了蛋白质编码区的序列时(例如发生移码突变),则可能引发功能性的基因敲除。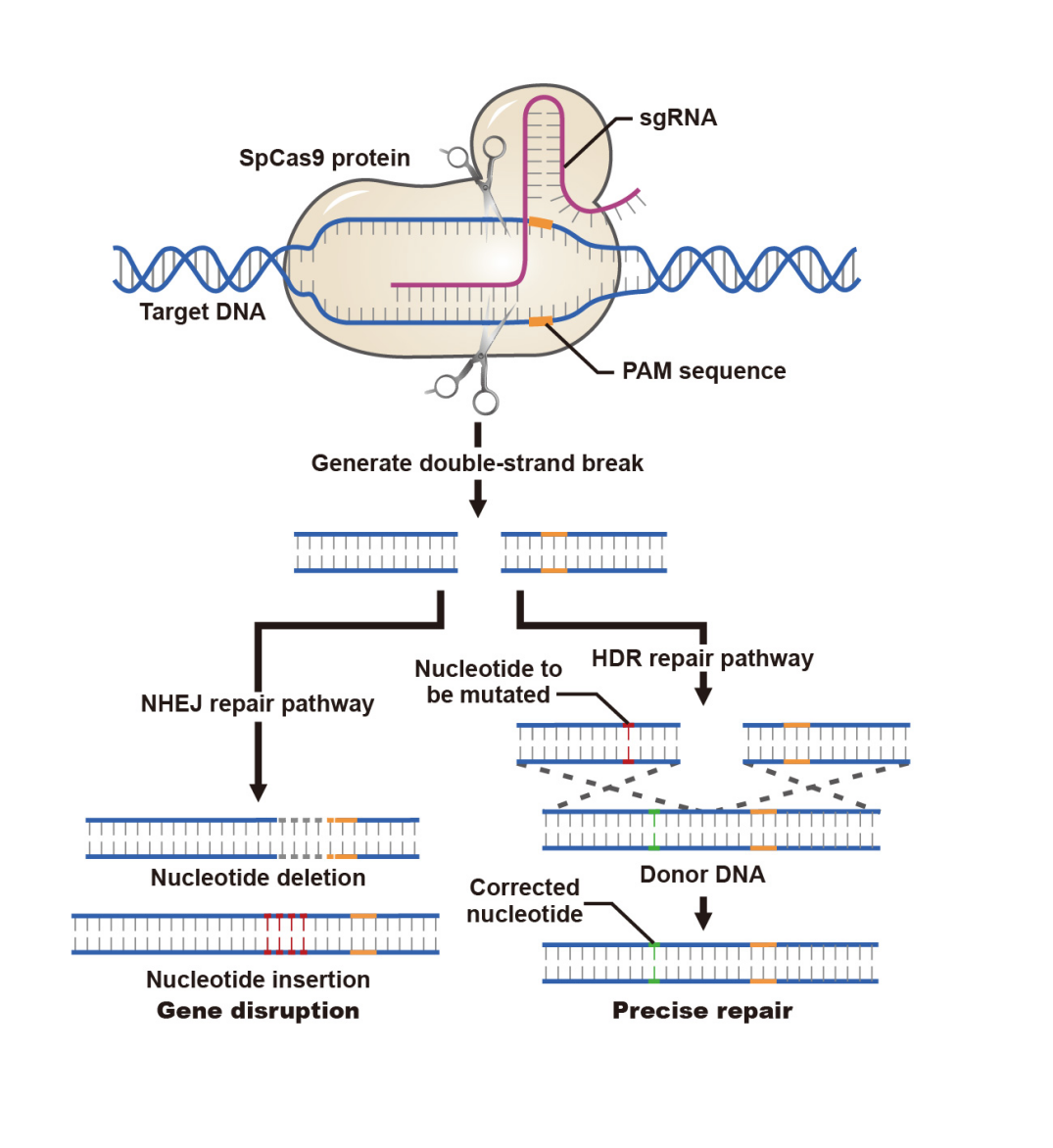
另一种情况是,当共同引入外源的供体DNA模板和CRISPR组件时,细胞可以通过同源重组修复 (Homology directed repair,HDR) 途径修复DSB。这种修复方式效率较低,并导致目标基因组DNA序列被供体序列替换,该机制有利于精确地改变DNA序列,例如产生点突变或在目标位点敲入供体DNA序列。供体DNA模板可以是单链寡核苷酸(ssODN)或dsDNA 片段(通常是线性化的质粒DNA)。ssODN适用于引入点突变或小标签插入,而dsDNA片段则更适用于大片段敲入。
CRISPR/Cas9系统试验验证
云舟生物验证了使用gRNA与Cas9共表达载体的CRISPR基因编辑效果。(A)向稳定表达EGFP的HEK293T细胞(HEK293T-EGFP)转染表达Cas9:T2A:mCherry的常规质粒和靶向EGFP的scramble gRNA。转染后72小时,流式细胞术检测EGFP表达水平。MFI表示荧光强度中值。(B)显微镜(100x)观察EGFP和mCherry表达。(C)转染all-in-one CRISPR载体的细胞对比无转染细胞中的相对EGFP表达。相对EGFP表达量用以下公式计算:[MFI (experimental group) – MFI (WT HEK293T cells)] / [MFI (HEK293T-EGFP cells) – MFI (WT HEK293T cells)]。Mean±SD,ns P>0.05,ANOVA以及Tukey事后检验。(D)gRNA靶向的基因组DNA区域使用PCR进行扩增,基因编辑效果使用T7E1试验确认。
CRISPR敲除对比shRNA敲低
无论是shRNA介导的基因敲低抑或是CRISPR基因敲除都可能是研究基因功能丧失的富有价值的实验方法。针对这些方法的选择,通常会需要考虑以下事项:
是否改变靶基因的DNA序列
基因敲低载体表达shRNA抑制靶基因的mRNA,通过引发mRNA的切割抑制翻译过程。shRNA敲低不改变靶基因的DNA序列。CRISPR系统则是通过指导核酸酶切割基因组中的特定靶位点来发挥作用。然后这些切割位点被细胞低效地修复,从而导致修复部位的突变,比如产生基因的小片段插入或碱基缺失。这类突变的一部分会导致基因的阅读框移码、出现提前终止密码子等,最终导致目的基因的功能丧失。如果同时靶向基因组中两个相邻紧密的切割位点(距离几个kb),也可以导致其间区域的删除。
靶基因表达的抑制效率
shRNA敲低永远不会完全抑制靶基因的表达。即使对于最有效的shRNA,靶基因的一些残留表达也会保留。相比之下,在一小部分经过处理的细胞群中,CRISPR基因编辑产生突变,这可能导致基因功能完全丧失。
一致性和均一性
shRNA载体通常在转染/转导的细胞时获得较好的均一性,实验之间的一致性也较佳。相比之下,由于引入突变是随机的,CRISPR基因编辑效果在细胞之间的差异相当大。为了完全敲除细胞中的目的基因,必须敲除细胞中基因的所有拷贝。鉴于正常细胞具有任何基因的两个拷贝(X或Y连锁基因除外),而癌细胞可以具有两个以上的拷贝,这种完全敲除的细胞可能只占所有处理后的细胞的一小部分。出于这个原因,核酸酶介导的敲除实验需要通过测序来筛选克隆,以确定所有目的基因拷贝都被敲除的子细胞群。
脱靶效应
已有报道表明shRNA介导的基因敲低和核酸酶介导的基因敲除均会产生脱靶效应。脱靶效应的表征可以通过使用多个不同的shRNA 靶向同一基因来评估。如果一个基因被在多个不同的shRNA作用下仍然表现出一致的表征,则这种表征通常则不是脱靶效应带来的。对于CRISPR基因敲除,应分析含有功能丧失突变的多个克隆,以包含可能由脱靶突变引起的任何表征。此外,可以对克隆进行脱靶位点测序,通过生物信息学方法鉴定以查看它们是否已发生突变。

了解Cas9蛋白
CRISPR/Cas9基因编辑系统由Cas9蛋白和gRNA(guide RNA)组成。在细胞内,Cas9蛋白与gRNA形成复合物,能特异性鉴别出靶序列。此过程中,Cas9蛋白负责将复合物定点到靶DNA和剪切靶DNA。Cas9蛋白有6个结构域,分别是Rec I、Rec II、桥螺旋(Bridge Helix)、PAM互作结构域(PAM Interacting)、HNH和RuvC。Rec I是6个中最大的一个结构域,负责结合gRNA。一旦结合了靶DNA,桥螺旋就负责启动剪切。PAM互作结构域赋予Cas9对PAM序列的特异性要求,负责启动与靶DNA的结合。HNH和RuvC都是核酸酶结构域,负责对DNA执行剪切。

Cas9蛋白的结构
CRISPR/Cas9介导的基因编辑
云舟生物的CRISPR/Cas9表达载体中有两种Cas9供选择。最常用的Cas9是从Streptococcus pyogenes细菌中通过基因工程获得的(又名SpCas9或hCas9),可在靶位点产生DNA双链断裂 (Double strands DNA break,DSB)。另一种广泛使用的Cas9变体,即具有“切口酶”性质的Cas9,比如Cas9(D10A),可对DNA单链进行切割。如果将Cas9切口酶与两个gRNA同时使用,并且两个gRNA分别靶向位于单个目标区域两侧的两条相反DNA链,则切口酶将在每条链上产生一个单链切口,从而导致目标区域发生DSB。一旦通过CRISPR系统产生DSB,细胞就会激活非同源末端连接 (Non-homologous End Joining-NHEJ,NHEJ) 途径来修复DNA断裂,这通常会导致少量碱基的随机缺失,或者发生更罕见的碱基插入和碱基替换等突变。当这些突变破坏了蛋白质编码区的序列时(例如发生移码突变),则可能引发功能性的基因敲除。

CRISPR系统通过引发DNA修复机制实现基因编辑
另一种情况是,当共同引入外源的供体DNA模板和CRISPR组件时,细胞可以通过同源重组修复 (Homology directed repair,HDR) 途径修复DSB。这种修复方式效率较低,并导致目标基因组DNA序列被供体序列替换,该机制有利于精确地改变DNA序列,例如产生点突变或在目标位点敲入供体DNA序列。供体DNA模板可以是单链寡核苷酸(ssODN)或dsDNA 片段(通常是线性化的质粒DNA)。ssODN适用于引入点突变或小标签插入,而dsDNA片段则更适用于大片段敲入。
CRISPR/Cas9系统试验验证

云舟生物验证了使用gRNA与Cas9共表达载体的CRISPR基因编辑效果。(A)向稳定表达EGFP的HEK293T细胞(HEK293T-EGFP)转染表达Cas9:T2A:mCherry的常规质粒和靶向EGFP的scramble gRNA。转染后72小时,流式细胞术检测EGFP表达水平。MFI表示荧光强度中值。(B)显微镜(100x)观察EGFP和mCherry表达。(C)转染all-in-one CRISPR载体的细胞对比无转染细胞中的相对EGFP表达。相对EGFP表达量用以下公式计算:[MFI (experimental group) – MFI (WT HEK293T cells)] / [MFI (HEK293T-EGFP cells) – MFI (WT HEK293T cells)]。Mean±SD,ns P>0.05,ANOVA以及Tukey事后检验。(D)gRNA靶向的基因组DNA区域使用PCR进行扩增,基因编辑效果使用T7E1试验确认。
CRISPR敲除对比shRNA敲低
无论是shRNA介导的基因敲低抑或是CRISPR基因敲除都可能是研究基因功能丧失的富有价值的实验方法。针对这些方法的选择,通常会需要考虑以下事项:
是否改变靶基因的DNA序列
基因敲低载体表达shRNA抑制靶基因的mRNA,通过引发mRNA的切割抑制翻译过程。shRNA敲低不改变靶基因的DNA序列。CRISPR系统则是通过指导核酸酶切割基因组中的特定靶位点来发挥作用。然后这些切割位点被细胞低效地修复,从而导致修复部位的突变,比如产生基因的小片段插入或碱基缺失。这类突变的一部分会导致基因的阅读框移码、出现提前终止密码子等,最终导致目的基因的功能丧失。如果同时靶向基因组中两个相邻紧密的切割位点(距离几个kb),也可以导致其间区域的删除。
靶基因表达的抑制效率
shRNA敲低永远不会完全抑制靶基因的表达。即使对于最有效的shRNA,靶基因的一些残留表达也会保留。相比之下,在一小部分经过处理的细胞群中,CRISPR基因编辑产生突变,这可能导致基因功能完全丧失。
一致性和均一性
shRNA载体通常在转染/转导的细胞时获得较好的均一性,实验之间的一致性也较佳。相比之下,由于引入突变是随机的,CRISPR基因编辑效果在细胞之间的差异相当大。为了完全敲除细胞中的目的基因,必须敲除细胞中基因的所有拷贝。鉴于正常细胞具有任何基因的两个拷贝(X或Y连锁基因除外),而癌细胞可以具有两个以上的拷贝,这种完全敲除的细胞可能只占所有处理后的细胞的一小部分。出于这个原因,核酸酶介导的敲除实验需要通过测序来筛选克隆,以确定所有目的基因拷贝都被敲除的子细胞群。
脱靶效应
已有报道表明shRNA介导的基因敲低和核酸酶介导的基因敲除均会产生脱靶效应。脱靶效应的表征可以通过使用多个不同的shRNA 靶向同一基因来评估。如果一个基因被在多个不同的shRNA作用下仍然表现出一致的表征,则这种表征通常则不是脱靶效应带来的。对于CRISPR基因敲除,应分析含有功能丧失突变的多个克隆,以包含可能由脱靶突变引起的任何表征。此外,可以对克隆进行脱靶位点测序,通过生物信息学方法鉴定以查看它们是否已发生突变。