云舟生物科技(广州)股份有限公司品牌商
8 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
还在用普通腺病毒研究基因疗法?来了解一下嵌合腺病毒/无肠腺病毒
1044 人阅读发布时间:2023-03-28 17:48

基因治疗,将外源性基因导入靶细胞,以纠正或补偿缺陷和异常基因引起的疾病,从而达到治疗目的。而困扰基因疗法前进最大的问题就是载体递送系统。载体系统需要安全性、免疫原性、转染效率、组织靶向等几大方面的考量。目前,基因疗法使用的载体分两大种,一种是病毒载体;另一种是非病毒载体。今天,载体家小课堂就来讲讲腺病毒载体,特别是嵌合型腺病毒和无肠腺病毒载体。
为什么要用嵌合型腺病毒/无肠腺病毒?
重组腺病毒载体是一种无包膜病毒载体,具有较大的双链DNA基因组(36 kb),可以在多种哺乳动物细胞类型中实现高水平的转基因表达。腺病毒载体具有很高的转导效率,并且可以实现短期记忆表达,通过该载体转导的外源DNA以游离体形式存在于细胞染色体之外,不整合宿主基因组。这些基础属性促使腺病毒载体经常被用于基因治疗研究和疫苗开发等领域。
普通Ad5腺病毒
野生型腺病毒通常会导致呼吸道感染,人体对其具有显著的免疫反应。为了拓展腺病毒载体在临床研究上的应用,重组腺病毒载体经过大量的改造以减低其毒性和增强安全性。其中早期的第一代腺病毒载体是复制缺陷型的血清型5(Ad5)腺病毒。该病毒载体通过删除了腺病毒E1A、E1B和E3基因使其不能在宿主细胞中自行复制,从而提高了生物安全性。
突破转导细胞类型:嵌合型Ad5/F35腺病毒
尽管人Ad5腺病毒载体至今仍被广泛使用,但是这种病毒载体的一个主要限制是其感染能力依赖细胞表面的CAR受体。对于CAR受体不表达或者表达不足的靶细胞,比如一些免疫细胞,Ad5血清型的腺病毒载体将无法高效感染。解决该问题的方法是改造腺病毒载体表面的纤突蛋白来调整其细胞嗜性,比如使用Ad5/F35嵌合型纤突蛋白。该纤秃蛋白包含来自腺病毒血清型35(Ad35)的顶端和杆部结构,以及来自 Ad5 的尾部结构。这使得 Ad5/F35 腺病毒载体能够利用 Ad35 纤突蛋白的特性与表达CD46受体的靶细胞结合,从而可以轻松地转导 CAR 阴性细胞或 CAR 表达水平较低的细胞。嵌合Ad5/F35 腺病毒载体拓展了腺病毒载体的细胞嗜性,使其能够高效转导造血细胞、原始干细胞、血管平滑肌细胞和 CAR 阴性的肿瘤细胞等细胞系,而这些细胞在传统的 Ad5 血清型中表现出较差的转导效率。
为什么要用嵌合型腺病毒/无肠腺病毒?
重组腺病毒载体是一种无包膜病毒载体,具有较大的双链DNA基因组(36 kb),可以在多种哺乳动物细胞类型中实现高水平的转基因表达。腺病毒载体具有很高的转导效率,并且可以实现短期记忆表达,通过该载体转导的外源DNA以游离体形式存在于细胞染色体之外,不整合宿主基因组。这些基础属性促使腺病毒载体经常被用于基因治疗研究和疫苗开发等领域。
普通Ad5腺病毒
野生型腺病毒通常会导致呼吸道感染,人体对其具有显著的免疫反应。为了拓展腺病毒载体在临床研究上的应用,重组腺病毒载体经过大量的改造以减低其毒性和增强安全性。其中早期的第一代腺病毒载体是复制缺陷型的血清型5(Ad5)腺病毒。该病毒载体通过删除了腺病毒E1A、E1B和E3基因使其不能在宿主细胞中自行复制,从而提高了生物安全性。
突破转导细胞类型:嵌合型Ad5/F35腺病毒
尽管人Ad5腺病毒载体至今仍被广泛使用,但是这种病毒载体的一个主要限制是其感染能力依赖细胞表面的CAR受体。对于CAR受体不表达或者表达不足的靶细胞,比如一些免疫细胞,Ad5血清型的腺病毒载体将无法高效感染。解决该问题的方法是改造腺病毒载体表面的纤突蛋白来调整其细胞嗜性,比如使用Ad5/F35嵌合型纤突蛋白。该纤秃蛋白包含来自腺病毒血清型35(Ad35)的顶端和杆部结构,以及来自 Ad5 的尾部结构。这使得 Ad5/F35 腺病毒载体能够利用 Ad35 纤突蛋白的特性与表达CD46受体的靶细胞结合,从而可以轻松地转导 CAR 阴性细胞或 CAR 表达水平较低的细胞。嵌合Ad5/F35 腺病毒载体拓展了腺病毒载体的细胞嗜性,使其能够高效转导造血细胞、原始干细胞、血管平滑肌细胞和 CAR 阴性的肿瘤细胞等细胞系,而这些细胞在传统的 Ad5 血清型中表现出较差的转导效率。

云舟生物的Ad5/F35腺病毒载体对比Ad5腺病毒载体转导效率。K562细胞是一种CAR低表达细胞系。表达EGFP的Ad5和Ad5/F35腺病毒在不同MOI下转导K562细胞,转导后48小时使用流式细胞术测量EGFP阳性细胞比例。
更大的装载量:无肠腺病毒
无肠腺病毒(Gutless adenovirus),也称为辅助病毒依赖型腺病毒载体。与传统的Ad5或嵌合Ad5/F35腺病毒载体相比,无肠腺病毒载体具有多种优势。除了病毒复制和包装所必需的顺式作用元件外,该病毒载体上几乎去除了所有病毒序列,这使得其在体内应用时仅具有很小的免疫原性以及延长的转基因表达时长。与Ad5 或Ad5/F35 相比,无肠腺病毒载体具有显着改善的安全性。此外,去除了病毒编码序列后,该载体可以具有更大的装载容量,可达33 kb,使其非常适合长或多转基因的表达。

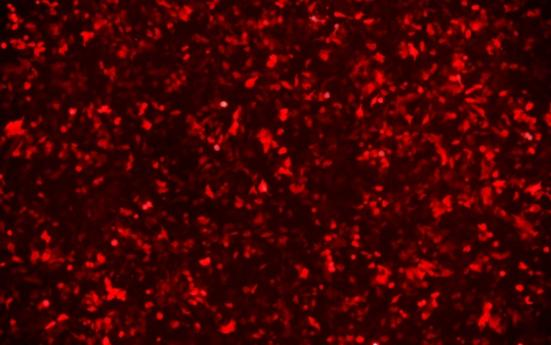
云舟生物验证无肠腺病毒载体转导HeLa细胞。MOI=5000。放大倍数:100x。上:明场,下:mCherry。
我们总结了不同类型腺病毒载体之间的差异,以帮助您根据实验需求选择合适的病毒载体。