云舟生物科技(广州)股份有限公司品牌商
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
载体家小课堂| 搞生物的总要看看吧:一文了解Cas9非病毒载体基因递送
2698 人阅读发布时间:2023-05-08 13:57
CRISPR/Cas9技术是当前一种极为常用的基因编辑工具。该技术中,具备切割DNA能力的Cas9核酸酶可以与特定的向导RNA(gRNA)分子形成RNP复合物,通过gRNA与靶位点的互补配对使Cas9定位到靶序列上,然后进一步切割基因组中的靶位点。
根据应用的不同,至今已经开发出的Cas核酸酶有多种类型,比如常用SpCas9以及SaCas9。SpCas9的序列来源于化脓性链球菌(Streptococcus pyogenes),是一种较大的Cas9蛋白,使用较为特异PAM序列(NGG)与靶DNA位点结合。SaCas9的序列则来源于某种球菌(Staphylococcus aureus),其分子量较小,适用于AAV等装载量小的病毒载体转导Cas9基因。SaCas9使用特异性较低的PAM序列(NNGRRT)识别DNA靶位点。
目前向细胞递送Cas9基因用于基因编辑有多种方式,然而对于基因治疗临床研究,为达到足够的安全性,更多人开始关注以下多种非病毒载体的转基因方法。
Cas9 质粒DNA
质粒DNA是一种十分常用的基因递送载体。制备质粒DNA成本低廉、操作简易,可以在大肠杆菌中扩增。传统质粒DNA在细胞中可以存在较长时间,但是由于存在易引发免疫反应的骨架序列比如复制起点、抗性基因等,并且有随机整合宿主基因组的可能,因此具有明显的安全性问题。
对于含有Cas9表达框的质粒DNA,其质粒总长已经较大,会带来明显的转染效率问题。当前通过删除质粒DNA中细菌来源的骨架序列,保留只携带真核表达元件ORF的表达框,然后通过体外酶合成制备微环DNA(Minicircle DNA)是一种更具可行性的应用方案。
Cas9 IVT mRNA
随着新冠mRNA疫苗在全球的成功推广,越来越多人认识到IVT mRNA在基因递送方面的应用潜力。IVT mRNA在体外以T7 RNA聚合酶从质粒DNA转录合成RNA分子,不含有任何细菌DNA序列,在体内具有更高的安全性。
在CRISPR系统中,使用IVT mRNA同样可以将Cas9基因导入靶细胞进行表达。Cas9 mRNA对比质粒系统还具有以下几点优势:
★ 由于mRNA相比质粒DNA可以更快地翻译产生Cas9蛋白,并且其随后在较短的时间内降解,因此不像质粒DNA那样长期停留在细胞内转录表达Cas9,有利于减少了基因编辑中的脱靶效应。
★ 作为RNA分子,Cas9 mRNA不会整合宿主基因组,极大减少了转导外源基因可能引发的插入突变以及基因组变化。
★ Cas9 mRNA在转染细胞的方式上可选择的方式更多,可以使用电转法、化学转染法、以及毒性更低的方法,比如利用LNP封装的mRNA。
★ 经过序列优化的Cas9 mRNA接近真核生物细胞内的天然核酸分子,免疫原性更低,翻译表达出Cas9基因的效率高。
Cas9-gRNA RNP复合物
与以DNA/RNA为基础的递送技术相比,在细胞内表达Cas9蛋白也可以采用基于蛋白质的核糖核蛋白复合物(RNP)体系。RNP体系直接在体外将Cas9蛋白和gRNA组装形成RNP复合物,然后通过电转法等方式导入靶细胞,实现Cas9的瞬时表达。RNP体系的细胞毒性更低,半衰期更短(<48 h),采用其进行基因编辑可带来更低的脱靶效应。但是由于RNP在血液中易被蛋白酶降解,因此RNP介导的CRISPR基因编辑更多用于体外实验。
不同非病毒载体用于递送Cas9基因的比较
| 类型 | 质粒DNA | IVT mRNA | RNP |
|
Cas9表达速度 |
低 |
中等 |
高 |
|
基因编辑效率 |
中-高 |
中等 |
中-高 |
|
分子稳定性 |
高 |
中等 |
中等 |
|
细胞中的表达时长 |
长时间 |
中等时长 |
短 |
|
免疫原性 |
高 |
中等 |
中等 |
|
细胞毒性 |
中等 |
低 |
低 |
|
插入突变风险 |
有风险 |
无 |
无 |
|
生产速度 |
快速 |
中等 |
低 |
|
使用成本 |
低 |
中等 |
高 |
云舟生物现货hSpCas9 IVT mRNA
云舟生物提供适用于体外和体内实验的现货人源化Cas9 mRNA产品。我们的mRNA以体外转录方式制备,可进行N1-甲基假尿苷(m1Ψ)修饰。经过试验验证,我们的hSpCas9 IVT mRNA可以高水平表达SpCas9并实现靶位点基因编辑。
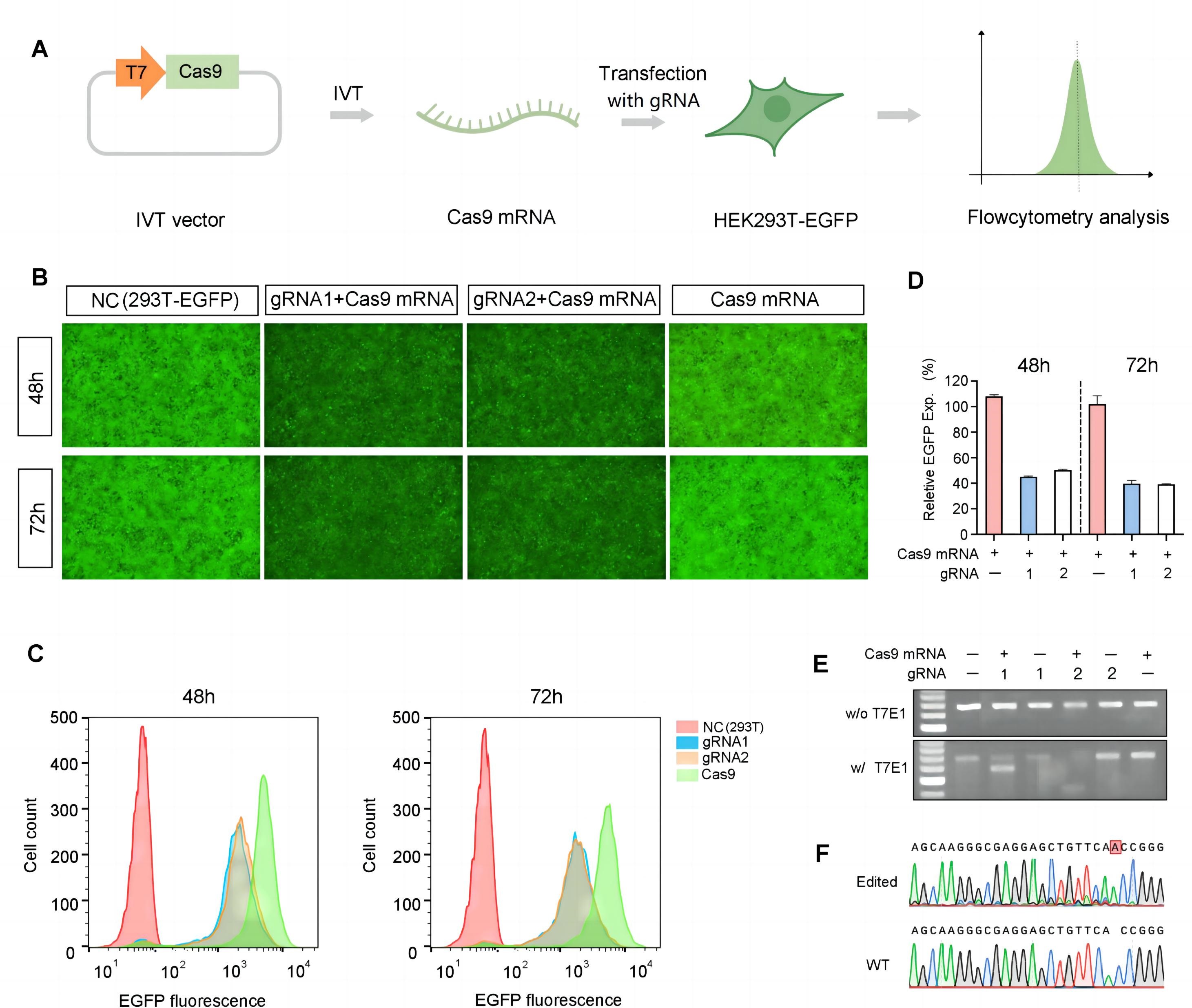
云舟生物hSpCa9 IVT mRNA在体外的基因编辑效果
(A)向表达EGFP的HEK293T细胞转染打靶RGFP的gRNA以及经过N1-甲基假尿苷(m1Ψ)修饰的hSpCas9 IVT mRNA。(B)通过显微镜(100X)观察无转染的(NC)以及转染的两组细胞。(C)流式细胞术定量检测荧光强度。(D)转染后48或72 h,转染后的细胞相对NC减少了约40%的EGFP表达量。(E和F)基因编辑效果通过T7E1酶切(E)和Sanger测序确认(F)。高亮表示的腺嘌呤表明了在靶序列的插入突变。
参考文献
1. Ates I, Rathbone T, Stuart C, Bridges PH, Cottle RN. Delivery Approaches for Therapeutic Genome Editing and Challenges. Genes (Basel). 2020 Sep 23;11(10):1113.
2. Lin Y, Wagner E, Lächelt U. Non-viral delivery of the CRISPR/Cas system: DNA versus RNA versus RNP. Biomater Sci. 2022 Mar 2;10(5):1166-1192.
3. Rouatbi N, McGlynn T, Al-Jamal KT. Pre-clinical non-viral vectors exploited for in vivo CRISPR/Cas9 gene editing: an overview. Biomater Sci. 2022 Jun 28;10(13):3410-3432.