云舟生物科技(广州)股份有限公司品牌商
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
载体家课堂 | 无肠腺病毒与DMD基因治疗
612 人阅读发布时间:2023-06-28 15:14
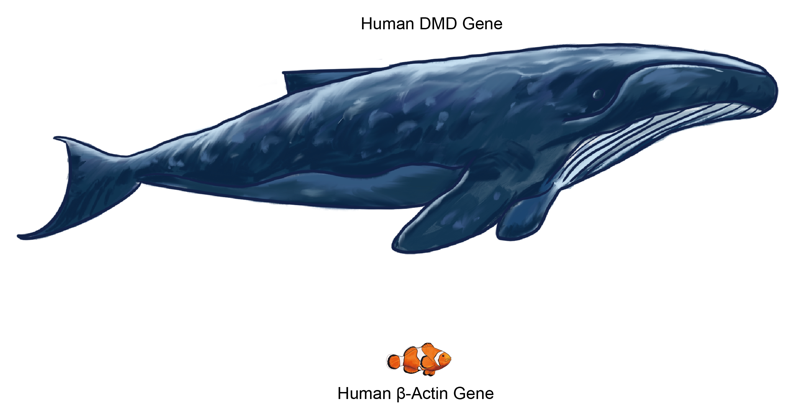
人β-肌动蛋白的基因与DMD基因的大小对比
虽然AAV已经被用于探索DMD治疗方法,但是由于装载量的限制(AAV的两个ITR之间仅能携带4.7 kb的序列),这些疗法中只使用了非全长的微型版本的DMD基因。当前,使用微型DMD基因的AAV基因疗法治疗DMD仍处于不同的临床试验阶段,并且仍需要评估其治疗效果。AAV系统由于其很低的免疫原性以及很小的副作用在基因治疗中十分流行,但是使用更长版本的DMD基因的系统在临床上仍然值得进一步研究。
CRISPR基因编辑是另一种具备潜力的DMD基因治疗技术。使用这种方法可以对基因组突变进行矫正。目前也有临床前研究对该方法进行了探索,然而DMD可以是由不同的突变引起的,因此这种方法可能需要根据不同的基因突变进行优化。此外,目前的CRISPR/Cas9技术无法挽救DMD的某些突变状况。
无肠腺病毒

无肠腺病毒基因组(下)与第一代重组腺病毒基因组(上)比较
云舟生物的无肠腺病毒载体中的stuffer DNA使用的是人源的非编码序列,因此其随载体进入人体细胞不会产生显著的免疫原性,安全性更佳(早期的stuffer DNA使用非人源的如λ噬菌体DNA,注射后在细胞表面呈递λ噬菌体多肽,引发细胞毒性T淋巴细胞的免疫应答反应)。
GLAd与传统重组腺病毒的生产方法也略有不同,对于GLAd,需要使用线性化的质粒与包含floxed包装信号的辅助病毒共转染表达Cre重组酶的包装细胞。辅助病毒最后在细胞内因Cre重组反应失活,此时从细胞中裂解可以获得粗制的病毒颗粒,然后用于下一步扩增。
GLAd 目前被用于多种遗传疾病的基因治疗研究,包括亨廷顿舞蹈病和DMD。GLAd更大的装载能力使其成为十分有吸引力的基因治疗载体。GLAd对比腺病毒装载容量更大,可容纳33 kb的转基因DNA。而与AAV系统相比,GLAd的装载能力已足以容纳两条DMD基因的成熟mRNA分子(14 kb)。事实上,McGill大学的研究人员早前已尝试了在肌营养不良小鼠模型中利用GLAd载体较为长期地表达了鼠Dys蛋白,并观察到了显著的治疗效果。尽管转导的DMD基因最终在动物体内发生了丢失,持续优化该基因递送系统将为治愈DMD患者带来更多的可能性。