云舟生物科技(广州)股份有限公司品牌商
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
肿瘤精准治疗的新希望——浅谈溶瘤病毒设计策略
1182 人阅读发布时间:2024-06-27 09:17
溶瘤病毒作为一种新式肿瘤疗法,通过利用病毒的天然特性,在激活免疫系统的同时,可以感染并裂解肿瘤细胞。这些经过基因工程改造的病毒可以在肿瘤微环境(TME)中复制,但是不能在正常细胞中复制,从而实现针对肿瘤的精准治疗。
当前被用于制备溶瘤病毒的病毒类型包括痘苗病毒(VACV)、单纯疱疹病毒(HSV)、腺病毒和水泡性口炎病毒(VSV)等。本文将深入探讨溶瘤病毒VACV和HSV的用于提高治疗效果的不同设计策略。
决定溶瘤能力的关键因素
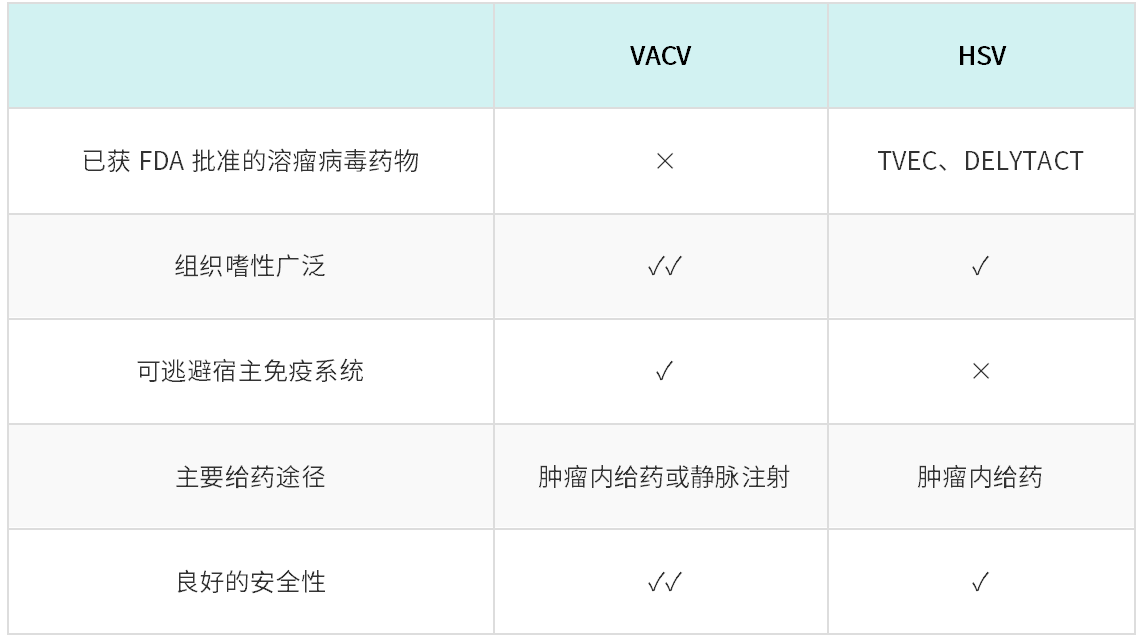
在评估溶瘤病毒系统的治疗能力时,必须考虑重要因素包括病毒的组织嗜性、裂解肿瘤细胞的能力和安全性。尽管当前已有针对不同类型的溶瘤病毒的大量研究,被批准用于临床使用只有两种基于HSV-1的溶瘤病毒。HSV的以下关键特性使其成为癌症治疗中最常用的溶瘤病毒。首先,HSV可以感染许多包括神经元在内的不同类型的细胞,并且由于肿瘤细胞上HSV受体(nectin-1和疱疹病毒侵入介质)的过表达而具有自然嗜肿瘤特性。感染后,HSV可以凭借其快速的生命周期迅速在肿瘤细胞中传播,从而促进细胞裂解和进一步的感染循环。虽然野生型HSV对人类具有致病性,但可以通过修改其基因组来抑制病毒在正常细胞中的有效复制,而且其安全性也因为当前存在有效的抗HSV治疗而得到保证。
与HSV相比,VACV作为溶瘤病毒具有一些明显的优势,尽管目前还没有获得临床批准。与HSV类似,VACV也显示出对肿瘤细胞的天然嗜性,这是因为肿瘤细胞具有过表达某些促病毒复制的蛋白质的特性,比如表皮生长因子受体(EGFR)。由于VACV不依赖受体结合而通过病毒包膜与宿主细胞膜融合的过程进入细胞,VACV对比HSV-1具有更广泛的组织嗜性。此外,与HSV一样,VACV也可以在肿瘤中迅速传播,引起细胞裂解。VACV的安全性良好,已通过广泛的研究和数据证实,其作为天花疫苗的临床应用也证明了这一点。现代VACV毒株已经过定向进化改造增强了裂解潜力(比如西储毒株显示出高溶瘤活性),并且与HSV类似,其基因组可以被修改以减弱病毒在正常细胞中的复制。
VACV相对于HSV-1的一个主要优势是可以促进补体控制蛋白的分泌,这种蛋白能够抑制宿主抗体和补体反应。这对于临床应用是特别有利的,VACV可以通过静脉注射并避免被免疫系统清除,从而保持良好的疗效。相比之下,基于HSV的溶瘤病毒药物,如TVEC,则需要通过直接向肿瘤内注射给药,这是一种复杂且侵入性的方法,不但增加了感染风险,也限制了当前基于HSV的药物只能针对容易接近的特定癌症类型(如肉瘤和黑色素瘤)给药,而VACV更适合针对难以到达的部位(如胰腺癌和肝癌)和转移性癌症。
VACV和HSV作为溶瘤病毒的相互比较
选择溶瘤病毒的类型
在开始设计溶瘤病毒时,无论是VACV还是HSV都是良好的选择。这两种重组病毒都非常适合通过基因改造极大地提高它们作为溶瘤病毒的疗效和安全性。VACV和HSV都有一个特别的优势是它们分别拥有190 kb和150 kb的大基因组,这使得它们能够插入很大的转基因片段。处理这种长度的基因组时的一个主要的技术难点是进行载体克隆和基因修饰——因为无法使用传统质粒系统,而必须改用使用其他克隆系统,如细菌人工染色体(BAC)和酵母人工染色体(YAC),也可使用结合了两者特性的BACYAC载体骨架。总而言之,重组VACV和HSV在提高溶瘤病毒药物的靶向性、增强肿瘤破坏能力、提高安全性从而为改善治疗治疗效果等方面均具有巨大的策略性设计空间。
增强肿瘤的靶向性
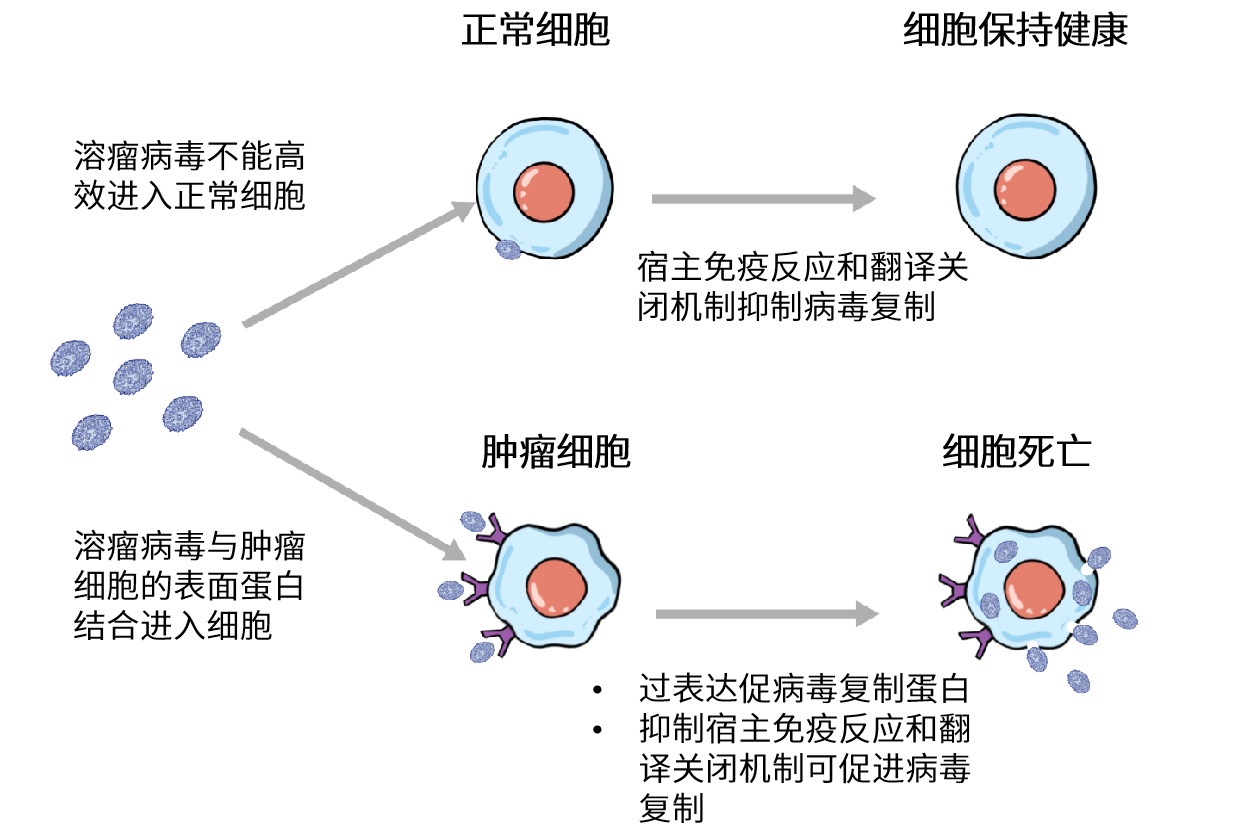
增强溶瘤病毒靶向性的一种策略是改造病毒包膜蛋白来增强病毒与肿瘤细胞受体的结合,或减少与正常细胞的结合,减低脱靶作用并使其在临床应用中更为有效。当这类病毒基因组表达治疗性转基因时,即可实现病毒特异性地感染和裂解肿瘤细胞。对于溶瘤HSV,其糖蛋白D的内源性受体结合域位置表达有HER2抗体,有助于病毒与过表达HER2的肿瘤细胞(如乳腺癌、卵巢癌和胶质母细胞瘤等肿瘤细胞)的结合。
另一种策略是,可以删除病毒基因组中肿瘤细胞中特异性表达且对病毒复制至关重要的基因,可以通过确保病毒只能在肿瘤细胞中增殖。例如,VACV溶瘤病毒JX-594删除了与DNA代谢关联胸苷激酶(TK)基因,使其不能在正常细胞中复制,但是受益于肿瘤细胞的宿主TK,其可以在肿瘤细胞在复制。而对于HSV,由于需要确保病毒对抗病毒核苷类似物药物更昔洛韦和阿昔洛韦敏感,TK基因通常会被保留。HSV中可以通过突变ICP6基因来减弱病毒在HSV中的复制(ICP6蛋白是一种对病毒基因组合成至关重要的酶),而细胞对病毒ICP6的丢失的补偿仅发生在分裂细胞中,如肿瘤细胞。
提高溶瘤病毒靶向性的另一种方法是阻碍病毒对宿主免疫反应的逃逸,确保病毒仅在肿瘤微环境中有效复制。在这个环境中,宿主的内源性免疫和翻译关闭现象受到抑制。对于HSV,一个常引入的突变是γ34.5基因突变。该基因编码的蛋白可抑制翻译起始并在病毒抵抗宿主IFN响应时发挥重要作用。γ34.5突变破坏了病毒的免疫逃避和病毒对宿主翻译关闭的抵抗力,从而阻碍了病毒在肿瘤微环境之外的正常细胞中复制。
溶瘤病毒对肿瘤细胞的选择性感染和复制
增强肿瘤细胞裂解能力:抗血管生成效应
设计溶瘤病毒时的一个重要考虑因素是如何提高病毒引发肿瘤破坏的效率。溶瘤病毒的复制是导致肿瘤细胞裂解死亡的直接结果。然而,病毒感染的也存在其它间接效应促进肿瘤的破坏,这些效应可以被利用来提高治疗成功率。通过在BACYAC骨架中引入靶向血管生成或免疫反应的转基因可以触发这种间接效应。
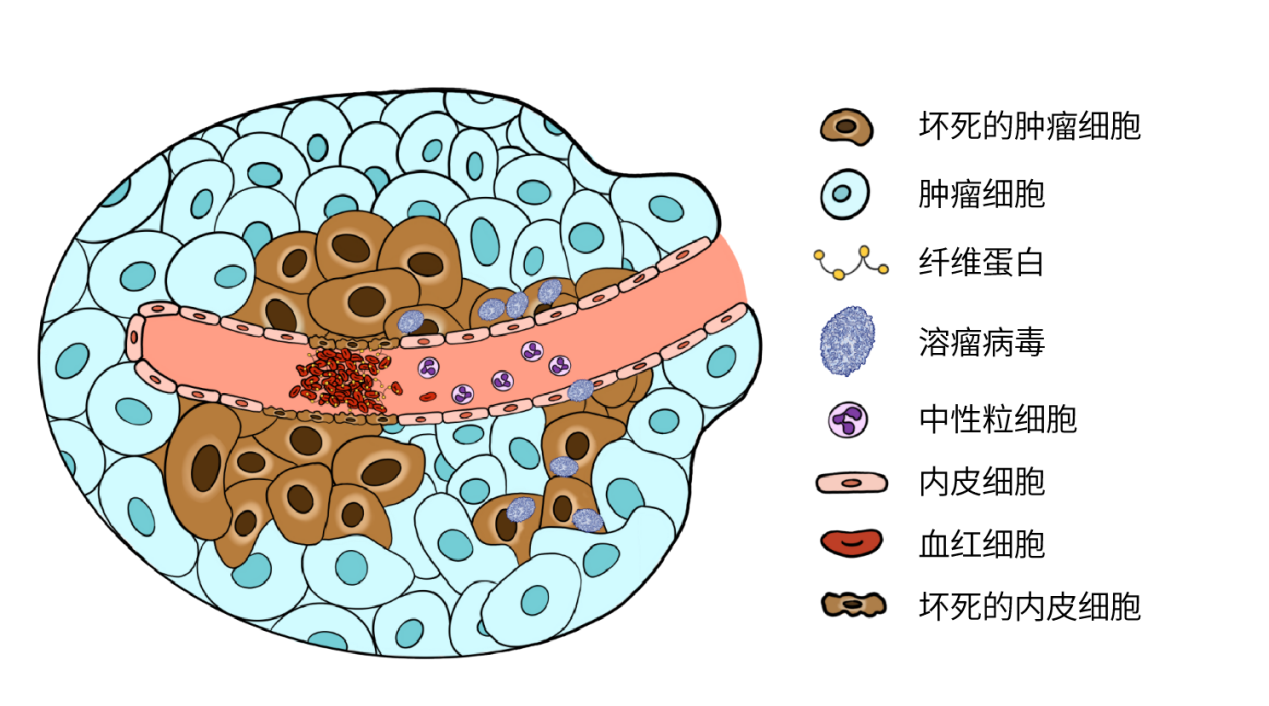
血管生成效应对肿瘤的存活至关重要,抑制这一过程基本上会使肿瘤失去必需的营养物质,从而抑制肿瘤生长。基于VACV的溶瘤病毒药物JX-594感染与肿瘤相关的血管内皮细胞时,会导致血管因内皮细胞直接受损,形成血栓并召集中性粒细胞(如图2所示)。在设计VACV溶瘤病毒时,可以考虑引入针对表皮生长因子受体(EGFR)和血管内皮生长因子(VEGF)的抗体的基因来实现抗血管生成效应。这种通过破坏受体-配体结合的策略已被证明可提高在小鼠中的治疗效果。
值得注意的是,增强溶瘤病毒的抗血管生成效应需要在破坏肿瘤和病毒传递之间获得平衡。通过破坏肿瘤的血液供应,病毒向其他肿瘤部位的传递可能会受到阻碍,而此时其他抗肿瘤药物的施用,如化疗药,也可能受到影响。这也是在溶瘤病毒设计的初始阶段必须考虑的一个与疗法相关得重要因素。
溶瘤病毒诱导的抗血管生成效应
增强破坏肿瘤能力:抗肿瘤免疫反应
在设计溶瘤病毒时,过表达那些能够帮助溶瘤病毒克服肿瘤微环境中的免疫抑制并激发有效抗肿瘤免疫反应的蛋白,被认为是一种值得实践的方法。这种策略对于长期的抗肿瘤效用和在临床应用上具有相当的优势。通过增加肿瘤部位的免疫细胞、促炎细胞因子和趋化因子数量,可为成功的免疫治疗(例如使用免疫检查点抑制剂或CAR-T这种过继性免疫治疗)做好准备。
实现该策略的一种方法是将编码促炎细胞因子的基因插入病毒基因组中,从而引导免疫细胞募集到肿瘤微环境。基于HSV的TVEC和基于VACV的JX-594两种溶瘤病毒均表达编码促炎细胞因子GM-CSF。其它类型促炎细胞因子,例如IL-12,也被证明在提高细胞毒性T细胞反应和刺激IFN-γ产生方面有效果。当前,表达IL-12的溶瘤性HSV(M032)在治疗复发性胶质母细胞瘤方面已进入临床I期试验。
还有一种方法是利用溶瘤病毒在肿瘤细胞上过表达可被T细胞识别的蛋白质。CAR-T细胞疗法依赖于对患者T细胞的修饰以识别肿瘤细胞表面的CD19分子。为了增强CAR-T疗法并激活患者的免疫系统以产生更有效的抗肿瘤免疫反应,可以利用VACV在肿瘤细胞表面过表达一个非信号传导的、截短版本的CD19。类似地,VACV也可以被修改以表达一种分泌型双特异性的T细胞衔接器(BiTE)。这是一种由识别T细胞表面抗原(如CD3)的抗体和一种针对肿瘤细胞表面抗原(如EphA2)的抗体组成的分子。通过这种分子T细胞将被导向肿瘤,增强抗肿瘤的免疫反应。
该种设计策略也需要考虑刺激抗肿瘤免疫反应与不妨碍病毒传播之间的平衡。对于VACV溶瘤病毒,为了可以针对全身范围内的转移性癌症进行治疗,这种平衡的考量将更显重要。
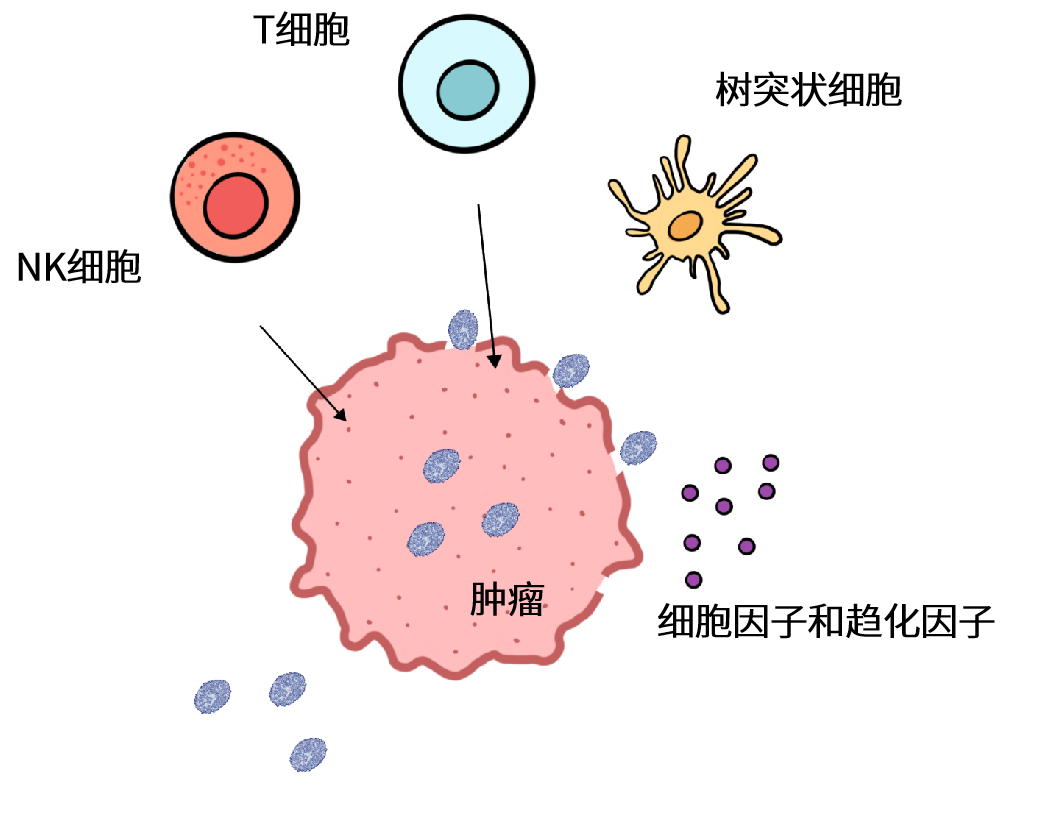
溶瘤病毒诱导的抗肿瘤免疫反应
VACV和HSV都可以被设计为高效的溶瘤病毒。这些重组病毒的基因组具有相当大的装载能力,在其自然溶瘤特性的基础上还能进一步修饰以增强病毒的靶向性、抗血管生成效应和抗肿瘤免疫反应。在构建这类溶瘤病毒的BACYAC载体过程中,对病毒基因组的克隆与修饰无疑是一项技术挑战。然而,云舟生物凭借其深厚的复杂载体克隆经验,能够确保这些病毒以高效、准确的方式得以制备。
随着当前溶瘤疗法领域知识的持续累积与更新,以及更多前沿遗传工具的投入使用,我们有理由相信,这将为开发更为高效、精准的溶瘤病毒提供新的机遇。