RAS癌基因家族,包括NRAS、HRAS及尤为关键的KRAS,频繁地在癌症中发生突变,其突变热点主要集中在密码子12、13和61上。针对KRAS(G12C)癌蛋白的小分子抑制剂,已经在不同癌症类型的患者治疗中展现出了显著的临床效果,并已被批准用于非小细胞肺癌的治疗。然而,KRASG12C突变在KRAS突变的癌症病例中仅占约15%,这意味着绝大多数携带其他常见KRAS突变的癌症患者,目前仍缺乏有效的、已获批的KRAS抑制剂。
为了解决这一问题,不久前美国抗肿瘤药物研发商Revolution Medicines在《自然》杂志上发表了题为“Concurrent inhibition of oncogenic and wild-type RAS-GTP for cancer therapy”的论文,介绍了一种新型可逆性三元复合物RAS抑制剂——RMC-7977,它展现出对突变型及野生型KRAS、NRAS、HRAS变体活性状态的广泛抑制作用,被归类为一种RAS(ON)多选择性抑制剂。

在临床前研究中,RMC-7977针对携带多样RAS基因型的RAS依赖性肿瘤,尤其是KRAS密码子12突变(KRASG12X)的癌症模型,展现出了强大的抑制效果。该抑制剂不仅促使肿瘤显著消退,而且在多种RAS依赖性临床前癌症模型中均表现出了良好的耐受性。此外,RMC-7977还能有效抑制那些因RAS信号通路恢复而对KRAS(G12C)抑制剂产生耐药性的KRASG12C癌症模型的生长。因此,RAS(ON)多选择性抑制剂如RMC-7977,具备针对多种致癌性及野生型RAS亚型进行靶向治疗的潜力,有望为RAS依赖性癌症患者带来曙光。
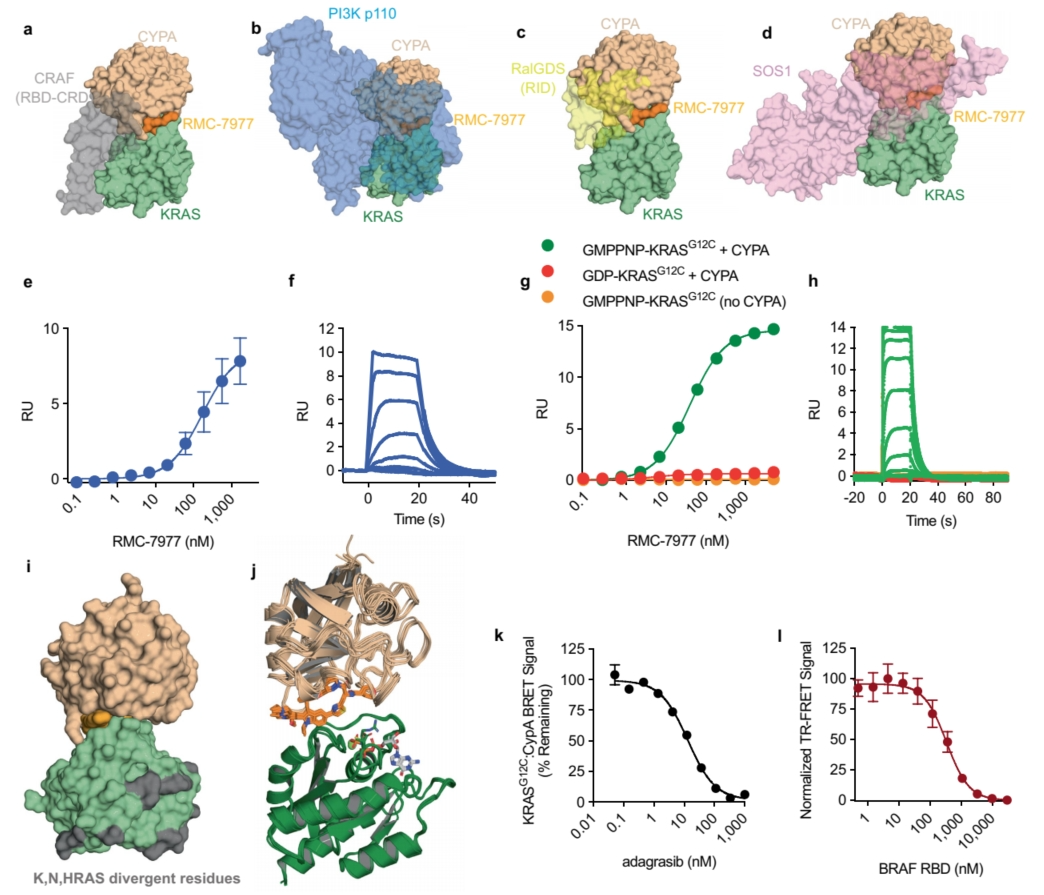
▲RMC-7977的结构特征和生物物理特性
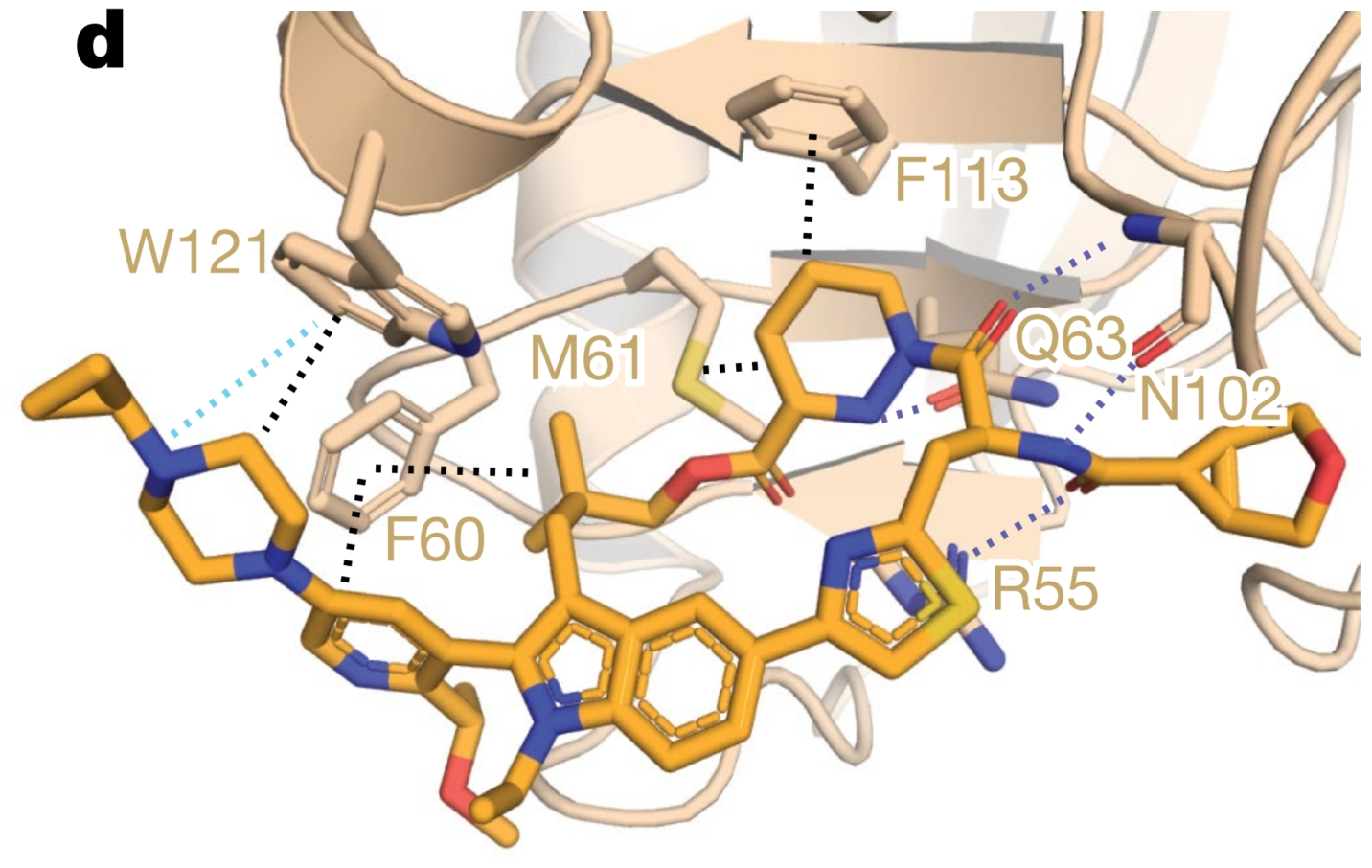
RMC-7977针对的是在各种癌症中频繁发生突变的致癌性RAS蛋白,尤其是非小细胞肺癌、结直肠癌和胰腺导管腺癌中的KRAS。这些突变通过稳定RAS蛋白的活性、GTP结合状态来驱动肿瘤进展。作为一种非共价、口服生物可利用的抑制剂,RMC-7977通过一种独特的三元复合物机制靶向多种活性RAS变体。该抑制剂首先与亲环素A(CYPA)结合,随后这种RMC-7977-CYPA复合物与活性RAS结合,形成一个三元复合物,从而阻断RAS与效应器的相互作用。这一机制使得RMC-7977能够对多种RAS变体(KRAS、NRAS、HRAS)及其常见的致癌性突变表现出强大的活性。抑制剂的细胞效力依赖于CYPA的表达水平,CYPA浓度越高,效果越显著。
在细胞研究中,RMC-7977有效抑制了RAS信号传导,特别是RAF-MEK-ERK通路,并抑制了RAS依赖性癌细胞的增殖。重要的是,该化合物对RAS依赖性癌症表现出相对于RAS非依赖性癌症(如BRAF V600E突变癌症)的选择性。这项研究代表了在直接靶向RAS蛋白方面的重大进展,而RAS蛋白历来难以抑制,并且是许多癌症的关键驱动因素。
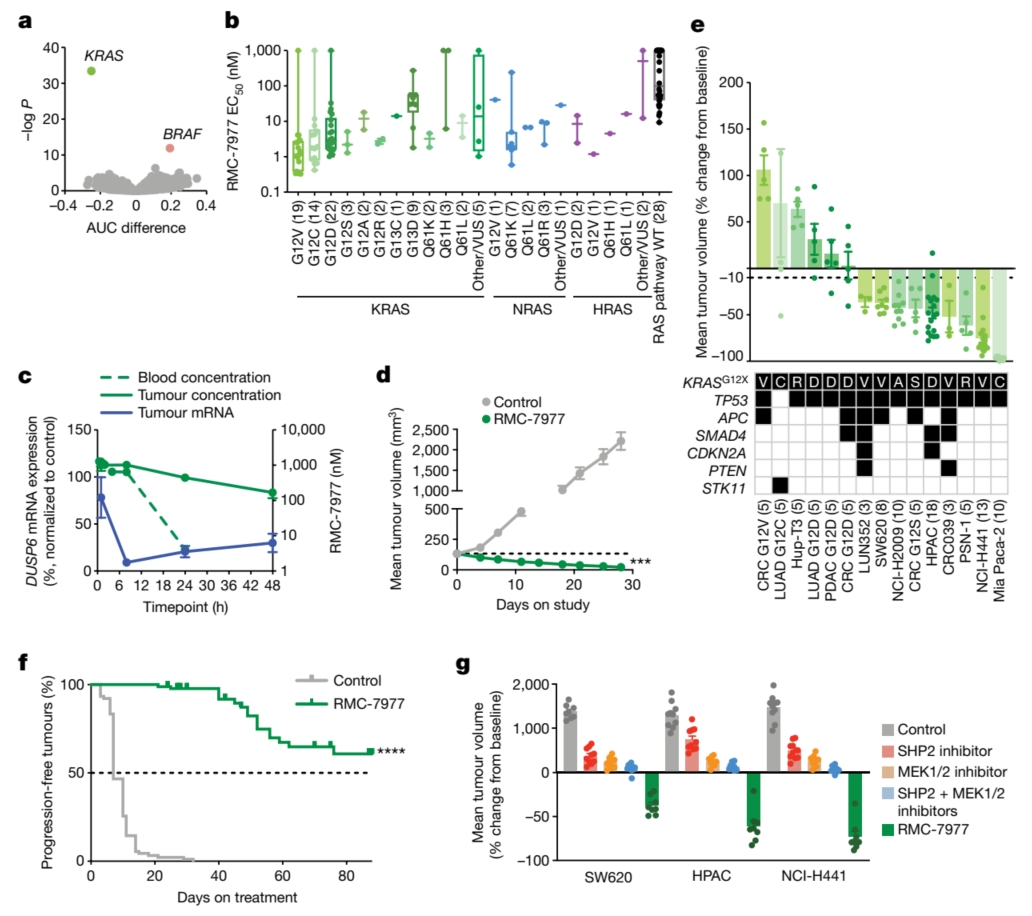
细胞存活率测定表明,致癌性KRAS突变是RMC-7977敏感性的最强预测因子。KRAS G12X突变细胞系表现出高敏感性,中位EC50为2.40 nM,而其他KRAS突变则显示出约10倍的较低敏感性。值得注意的是,具有NRAS和HRAS突变的细胞系,以及激活受体酪氨酸激酶的细胞系,也对RMC-7977有反应。在使用KRAS G12V非小细胞肺癌模型的体内研究中,RMC-7977有效抑制了RAS通路并诱导了肿瘤消退。该化合物在携带KRAS G12X突变的胰腺、结直肠和肺癌患者来源的异种移植模型中的抗肿瘤活性得到了进一步证实。
重要的是,与MEK和SHP2抑制剂相比,RMC-7977在KRAS G12X模型中表现出更优异的抗肿瘤活性。RMC-7977的有效性可能归因于对致癌性RAS信号传导的更有效抑制、对正常组织的影响较小,或这两种因素兼有。此外,RMC-7977在小鼠中不会损害免疫细胞功能,并观察到在KRAS G12C同基因型肿瘤中增加了肿瘤抗原特异性CD8+ T细胞的浸润。这些发现表明,RMC-7977是一种针对RAS驱动型癌症,特别是具有KRAS G12X突变的癌症的候选药物。
RMC-7977还有望克服当前RAS抑制剂(特别是针对KRAS G12C的抑制剂)的耐药机制。与突变特异性抑制剂不同,RMC-7977在KRAS G12D胰腺癌细胞中实现了对pERK的持久抑制。长期异种移植实验进一步揭示,RMC-7977相较于对照组显著延长了肿瘤倍增的时间。尤为关键的是,RMC-7977对通常使开关II口袋结合抑制剂失效的突变保持了强大的抑制作用。
其广谱活性特性使RMC-7977能够有效应对KRAS(G12C)抑制剂治疗患者中出现的耐药机制,包括继发性RAS突变和受体酪氨酸激酶(RTK)的激活。在因过表达各种RTK而对KRAS(G12C)抑制剂产生耐药性的细胞系中,RMC-7977同样展现出了有效的生长抑制作用。此外,在一名接受索托拉西布治疗后复发的非小细胞肺癌患者源性异种移植模型中,RMC-7977在肿瘤生长抑制方面明显优于索托拉西布。
RMC-7977的独特之处在于其能够靶向包括野生型RAS在内的多种RAS变体,这一特性预示着它可能同时克服KRAS(G12C)抑制剂的适应性和获得性耐药机制。因此,研究人员提出,RMC-7977及类似的广谱RAS抑制剂可单独使用或与突变特异性KRAS抑制剂联合使用,以提供更为广泛和有效的治疗选择。这项研究不仅凸显了RMC-7977在RAS驱动型癌症治疗中的巨大潜力,还为实现针对现有靶向疗法耐药性的新策略开辟了道路。
云舟生物为该研究分别构建了表达tTS调控蛋白、rtTA调控蛋白、四环素诱导的受体酪氨酸激酶(RTK)以及RTK融合蛋白的慢病毒载体,并进行了慢病毒包装。