许多研究表明,TET2基因与许多成年白血病病例密切相关,在慢性髓单核细胞白血病(CMML)患者中,其突变发生率高达60%。除癌症外,TET2突变还被发现会显著增加心脏病、中风、糖尿病和其他炎症性疾病的风险,但其具体原因及机制尚不明确。
TET酶家族(包括TET1、TET2和TET3)已被证明可以氧化哺乳动物DNA上最常见的修饰5-甲基胞嘧啶(5mC),最终导致5mC的去甲基化。其中,TET2在髓系恶性肿瘤中表现出显著的高突变率。TET2缺乏会导致基因组DNA低甲基化,且以往研究还显示TET2可以与RNA结合蛋白相互作用,影响RNA 5-甲基胞嘧啶的氧化。这表明TET2缺乏所引起的功能结果可能主要与其DNA氧化活性无关,而更可能涉及RNA m5C氧化。
2024年10月2日,芝加哥大学何川团队与德克萨斯大学圣安东尼奥健康科学中心徐明江团队合作在Nature期刊发表了题为RNA m5C oxidation by TET2 regulates chromatin state and leukaemogenesis的研究论文,首次揭示TET2的独特功能——通过调节caRNA上的m5C氧化作用影响染色质结构,从而控制白血病细胞的活动。该研究为白血病的诊断和治疗开辟了新视角。

何川教授是美国芝加哥大学的著名科学家,他的研究在化学生物学、表观遗传学和RNA生物学领域中具有广泛影响,尤其在“RNA表观遗传学”这一新兴领域中做出了开创性贡献。作为最早提出RNA表观遗传调控概念的科学家之一,他发现RNA的化学修饰对基因表达调控的核心作用,并揭示了RNA修饰在生物发育、癌症、免疫反应等方面的重要功能,这一系列工作为理解基因表达调控开辟了新的方向。
2023年,何川因其在RNA表观遗传学方面的开创性贡献,与东京大学的Hiroaki Suga和美国斯克利普斯研究所的Jeffery W. Kelly共同获得当年度沃尔夫奖,成为第9位获此殊荣的华人科学家。
-
MBD6在调控TET2缺失引起的染色质变化中的作用:通过shRNA敲低MBD6,结合染色质免疫沉淀测序(ChIP-seq)测量H2AK119去泛素化变化,并使用ATAC-seq评估MBD6敲低对染色质结构的影响,从而揭示MBD6在TET2缺失背景下的调控机制。
-
MBD6缺失对Tet2缺陷性造血干细胞(HSPCs)功能的逆转作用:在TET2缺失和MBD6敲低的HSPCs模型中,团队开展小鼠体内竞争性移植实验,评估MBD6敲低对HSPCs重建和分化的影响。
-
MBD6在TET2突变白血病中的治疗潜力:在TET2突变的白血病细胞系(K-562和THP-1)中,研究人员敲低MBD6以观察其对细胞增殖的影响,并在小鼠白血病模型中测试MBD6敲低对白血病细胞生长和生存的影响,以评估其作为TET2突变白血病潜在治疗靶点的可能性。
(图1 MBD6通过caRNA m5C结合调控染色质状态的途径示意图)
1.TET2缺失引发染色质开放性增加及PSPC1对RNA结合的调控作用
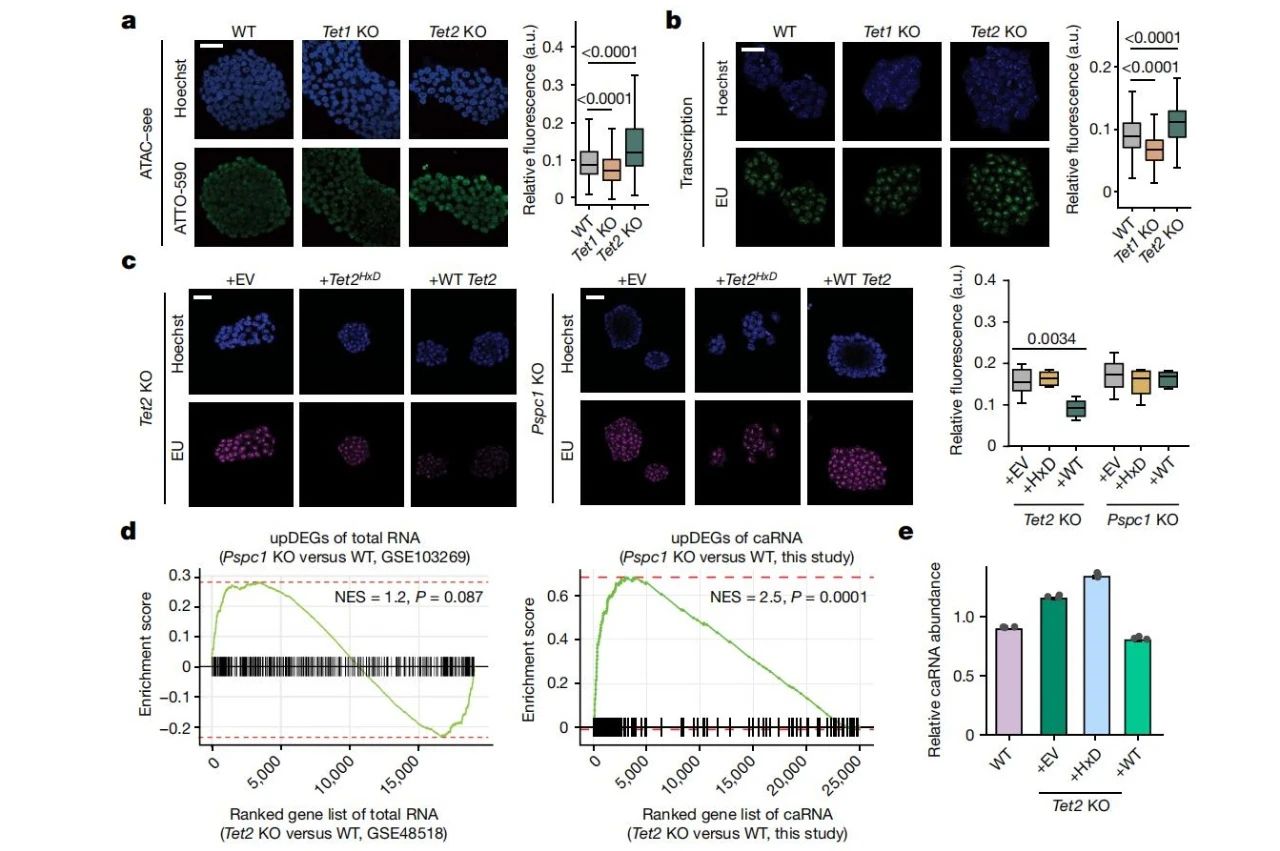
研究团队在TET2基因敲除(TET2-KO)的小鼠胚胎干细胞(mESCs)中评估了TET2缺失对染色质开放性和基因表达的影响。ATAC-seq分析表明,与野生型相比,TET2-KO细胞具有更开放的染色质状态,并伴随全局转录上调,尤其是在蛋白编码基因的转录速率上。该变化与全基因组DNA去甲基化一致,但并不依赖于DNA氧化。
进一步实验发现,Pspc1基因敲除(Pspc1-KO)也能增加染色质开放性,并在染色质可及区域上与TET2-KO细胞高度重叠。UHPLC-MS/MS检测显示,Pspc1缺失不会影响DNA 5mC,但显著提高了染色质相关RNA(caRNA)上的m5C水平。
此外,缺乏RNA结合能力的PSPC1突变体无法恢复染色质开放性,而TET2的过表达能够降低TET2-KO细胞的转录活性。以上结果表明,TET2通过RNA的催化活性来调控基因表达和染色质状态。
(图2 TET2缺失后PSPC1通过其RNA结合活性促进染色质可及性增加)
2.TET2介导的caRNA m5C氧化对染色质状态的调控作用
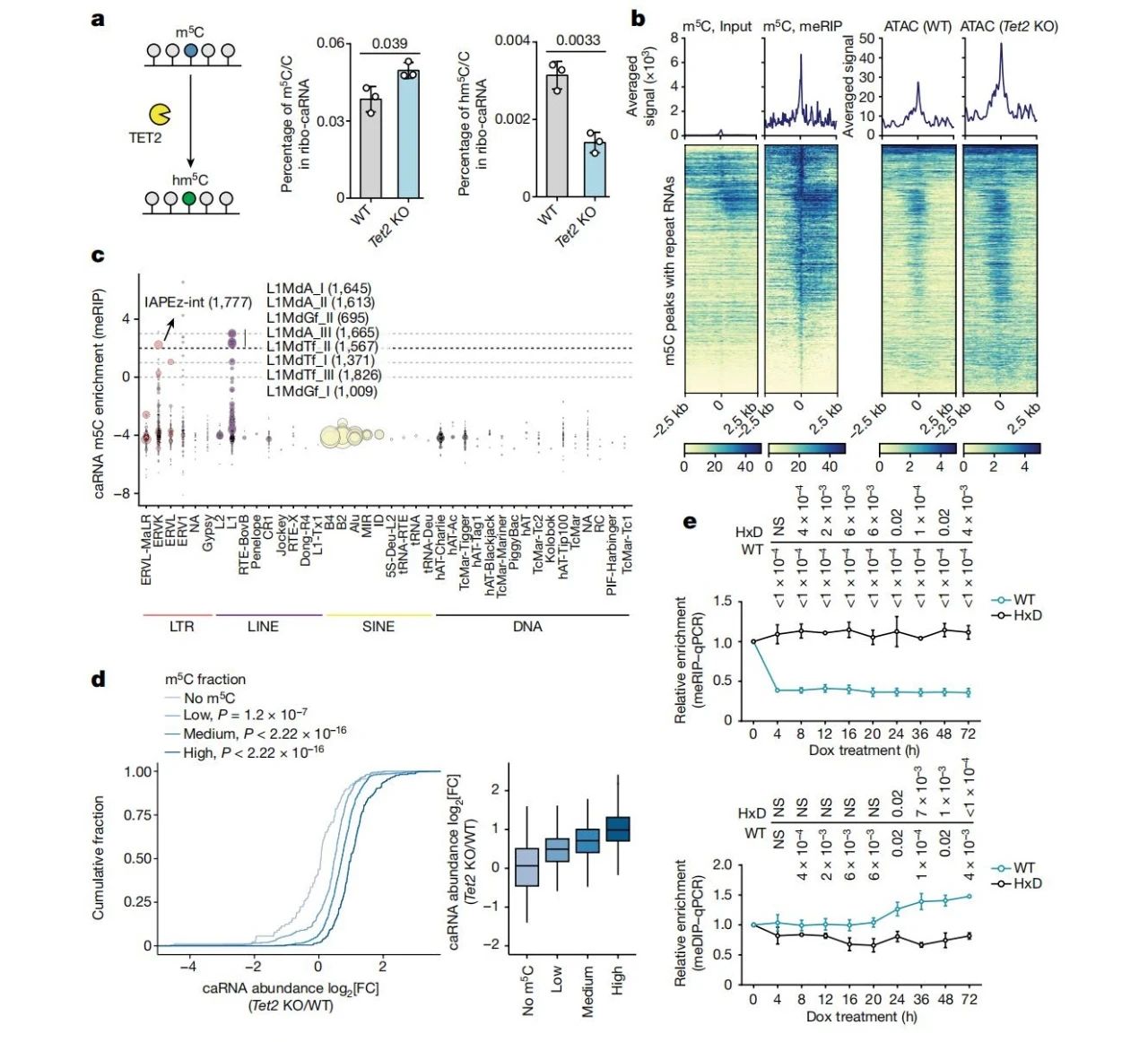
研究团队探讨了TET2是否通过caRNA的m5C氧化来调控染色质。使用UHPLC-MS/MS检测显示,TET2缺失增加了caRNA m5C水平并减少其氧化产物hm5C。通过m5C甲基化RNA免疫沉淀测序(MeRIP-seq),发现m5C主要集中在重复序列RNA中,尤其是LTR和LINE家族,并且这些区域的染色质开放性显著上升。
通过超快速重亚硫酸盐测序,发现TET2-KO细胞中ERVK和L1家族的重复序列RNA m5C过度甲基化,TET2的过表达则降低了这些区域的开放性。通过ASO靶向阻断IAP RNA的m5C位点,染色质变得更为封闭。此外,dCas13结合TET2催化结构域靶向IAP RNA后,RNA m5C氧化降低,DNA甲基化增加,进一步证实TET2的RNA m5C氧化在调控染色质状态中的关键作用。
(图3 TET2介导的caRNA m5C氧化调控染色质开放性)
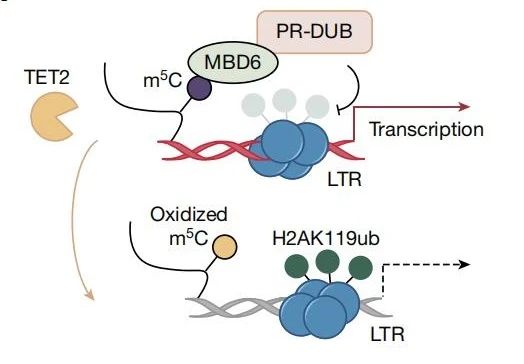
3.MBD6结合RNA m5C并调控染色质状态
进一步分析发现,H2AK119ub是与TET2介导的RNA氧化高度相关的组蛋白标记,由PRC1复合体加上,可被PR-DUB去除。研究发现,将dCas13-TET2-CD靶向至IAP区域可增加H2AK119ub水平。此外,MBD6蛋白能够特异识别m5C标记的RNA并招募PR-DUB复合体,来去泛素化H2AK119ub。研究表明,Mbd6 KD(敲低)能显著减少TET2 KO细胞的染色质开放性并增加H2AK119ub水平,恢复了TET2缺失的表型变化。这说明TET2通过减少MBD6对m5C RNA的结合和H2AK119ub的去泛素化,压缩染色质并抑制转录。
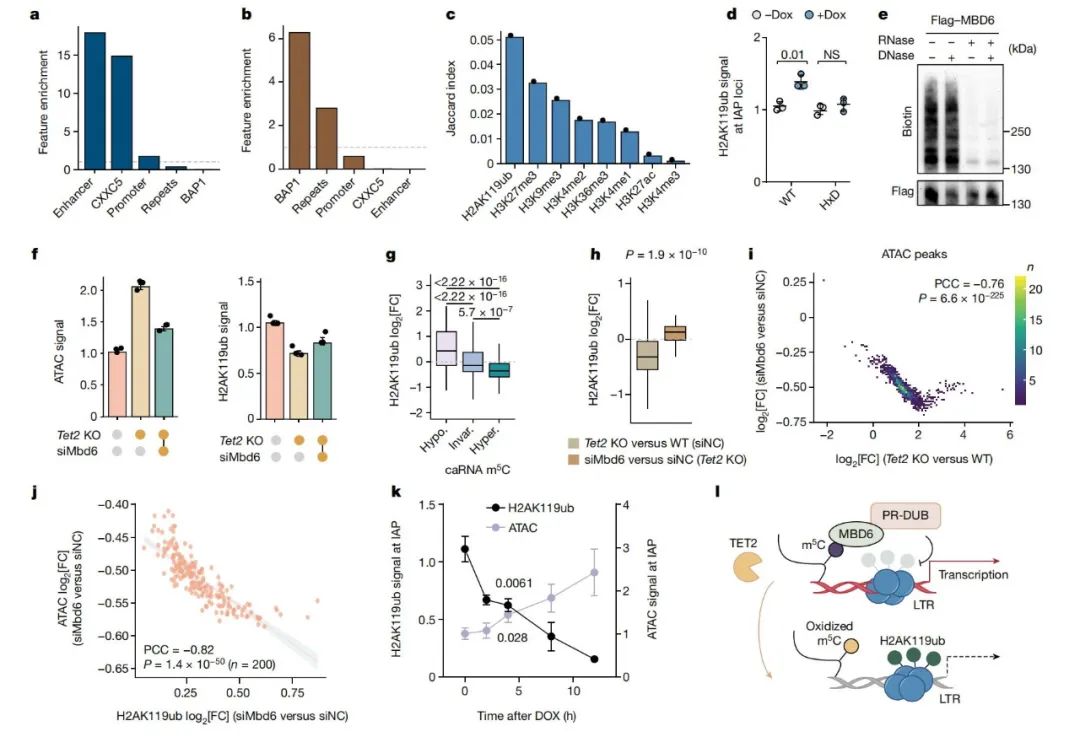
(图4 MBD6结合m5C标记的RNA并调控H2AK119ub去泛素化)
4.靶向抑制TET2缺陷性HSPCs中的MBD6以调控染色质状态和细胞分化
TET2缺失在造血干细胞和祖细胞(HSPCs)中会导致染色质开放和基因组不稳定,最终引发髓系恶性肿瘤。通过竞争性移植实验,研究人员发现TET2缺陷+shMbd6组表现出正常的供体细胞嵌合率,而TET2缺陷+shNC组的嵌合率显著增高,显示Mbd6 KD有效减少了TET2缺陷性HSPCs的自我更新潜能并促进分化。此外,Mbd6 KD显著恢复了TET2缺陷导致的染色质开放性增加和H2AK119ub水平降低,且H2AK119ub增加与染色质开放性下降高度相关。Nsun2 KD也部分改善了TET2缺陷性HSPCs的表型异常,但其他RNA m5C修饰酶的KD无显著效果。dCas13-TET2-CD靶向IAP RNA m5C进一步验证了IAP RNA m5C在调控HSPCs状态中的作用。
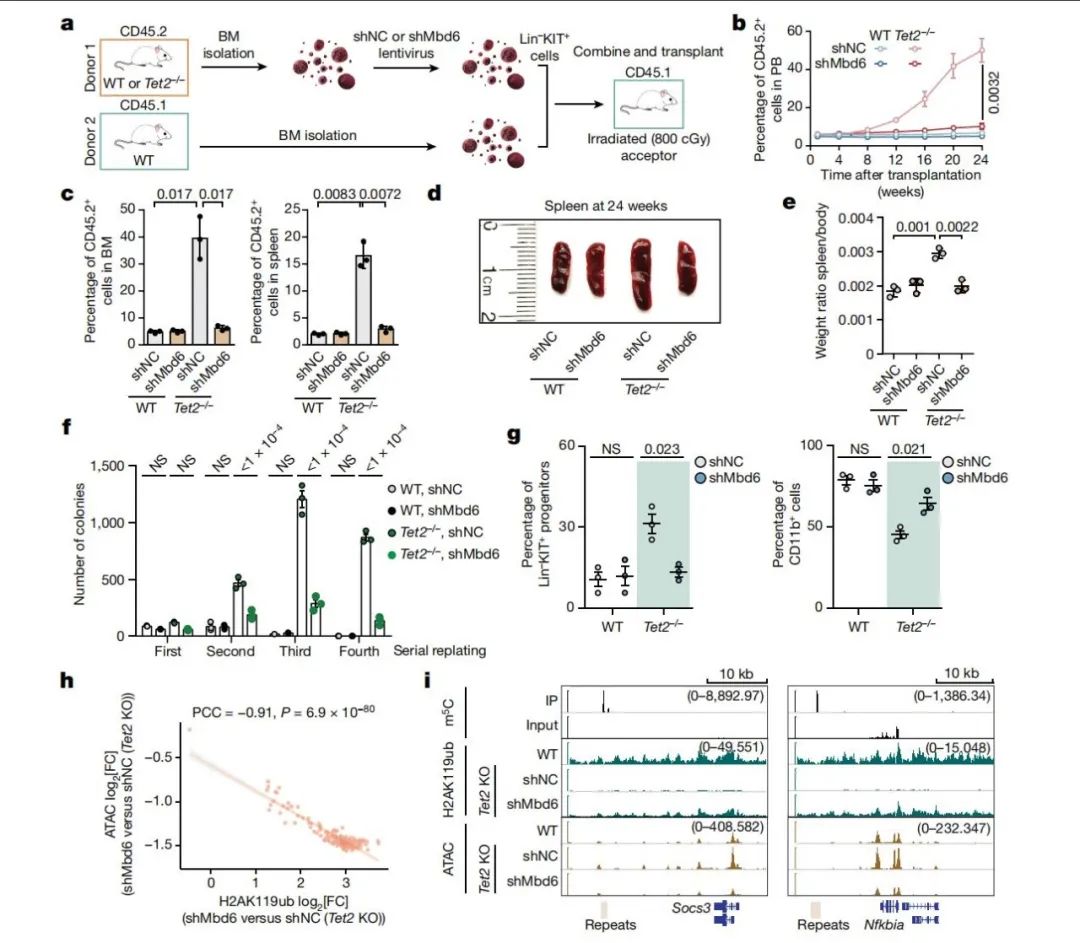
(图5 靶向MBD6敲低在TET2缺陷HSPCs中的作用)
5.靶向抑制MBD6以改善TET2突变性白血病细胞的增殖及存活
研究团队进一步在TET2突变性白血病细胞中探讨该机制,发现敲低MBD6几乎完全阻止了TET2突变细胞增殖。在TET2敲除的K-562和THP-1细胞中敲低MBD6,显著抑制了突变细胞的增殖,并使H2AK119ub水平上升。体内实验表明,移植TET2 KO+shMBD6细胞的小鼠显示白血病进展显著减缓,生存期延长。相较于对照组小鼠,敲低MBD6的白血病细胞骨髓嵌合率显著降低。此外,MBD6敲低恢复了TET2突变细胞中因染色质开放性增加而引发的过量caRNA表达,并逆转了H2AK119ub的降低。这些结果表明,MBD6抑制可以有效阻断TET2缺失引发的白血病增殖需求,显示出其作为治疗靶标的潜力。
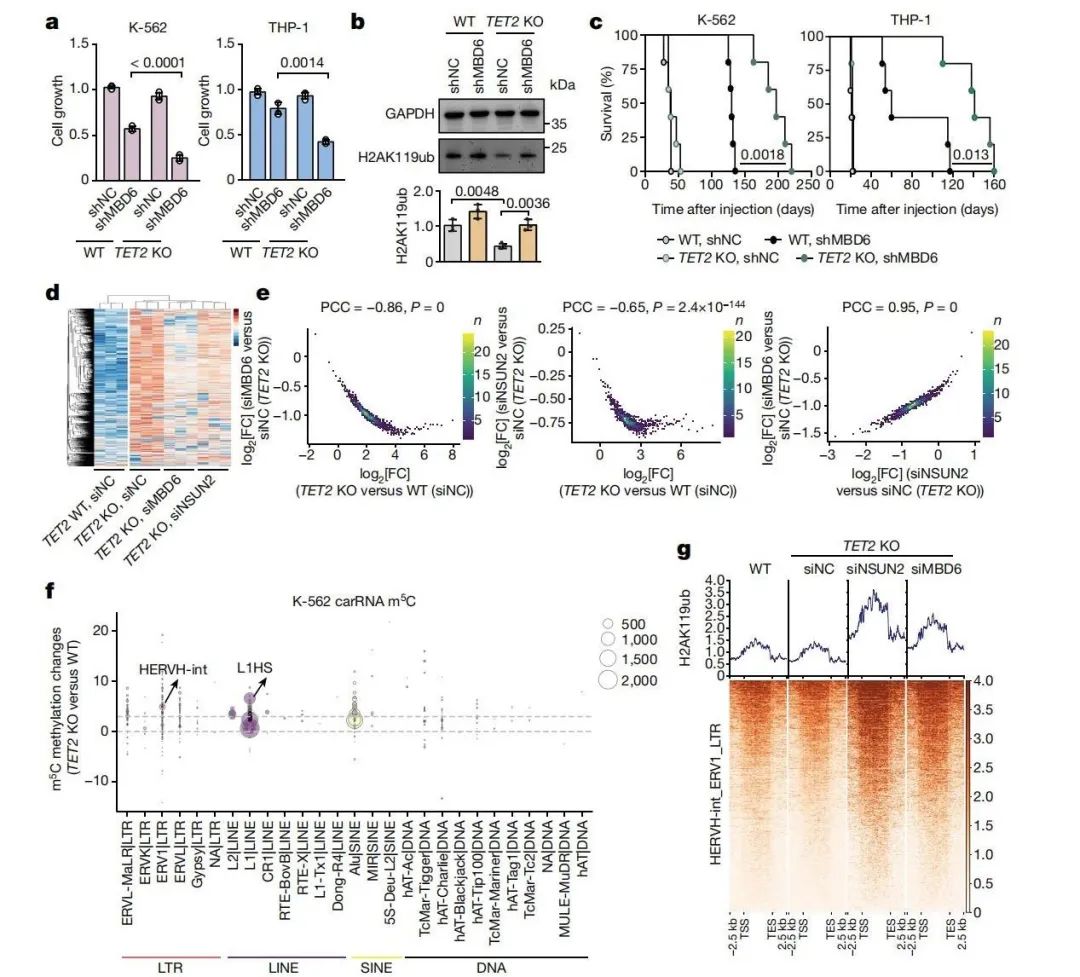
(图6 靶向MBD6敲低改善TET2突变白血病细胞的增殖及染色质状态)
何川和徐明江团队的这项研究首次发现TET2能够氧化RNA中的m5C,并且这一过程与染色质状态和白血病的发生密切相关。此外,研究还发现了MBD6蛋白能够特异性识别m5C修饰的RNA,并参与调控染色质中的H2AK119ub水平。这些发现为理解TET2在白血病发生中的作用提供了新的分子机制,并可能为白血病治疗提供新的靶点。同时,这一发现也可能对其他与染色质状态异常相关的疾病,如肿瘤和神经退行性疾病等,提供新的治疗思路。
在本研究中,云舟生物(VectorBuilder)提供了关键载体支持,包括靶向IAPEz序列m5C位点的crRNA载体及本研究所需要使用的mTET2催化结构域(以及其突变型)慢病毒载体的构建及验证,有力支持了研究的顺利完成。
【参考资料】
Zhongyu Zou et al., (2024) RNA m5C oxidation by TET2 regulates chromatin state and leukaemogenesis.