云舟生物科技(广州)股份有限公司品牌商
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
CRISPR-Cas9系统设计与载体优化的黄金法则
493 人阅读发布时间:2025-03-28 09:19
CRISPR-Cas9技术彻底革新了基因编辑方法,可高效地实现基因敲除、敲入、上调、或者敲低。为获得成功的编辑效果,使用CRISPR-Cas9系统时需要考虑一系列策略以及载体优化的方式。本文将就此进行相关介绍。
CRISPR系统简介
CRISPR-Cas9系统包含多个组分,这些组分根据所需的应用类型、载体系统和目标细胞类型而有所不同。然而,所有CRISPR系统都包含两个关键组分:Cas9核酸酶和向导RNA(gRNA)。
☞ gRNA是一种短RNA序列,通过与基因组上的DNA靶序列互补配对引导Cas9到达靶位点。
☞ Cas9是一种RNA引导的DNA核酸酶,只要靶序列相邻于一个称为原间隔相邻基序(PAM)的短DNA序列,它就可以在特定的基因组位置引入双链断裂(DSB)。一旦在目标位点引入DSB,细胞就会使用两种主要的DNA修复途径中的一种来修复断裂。
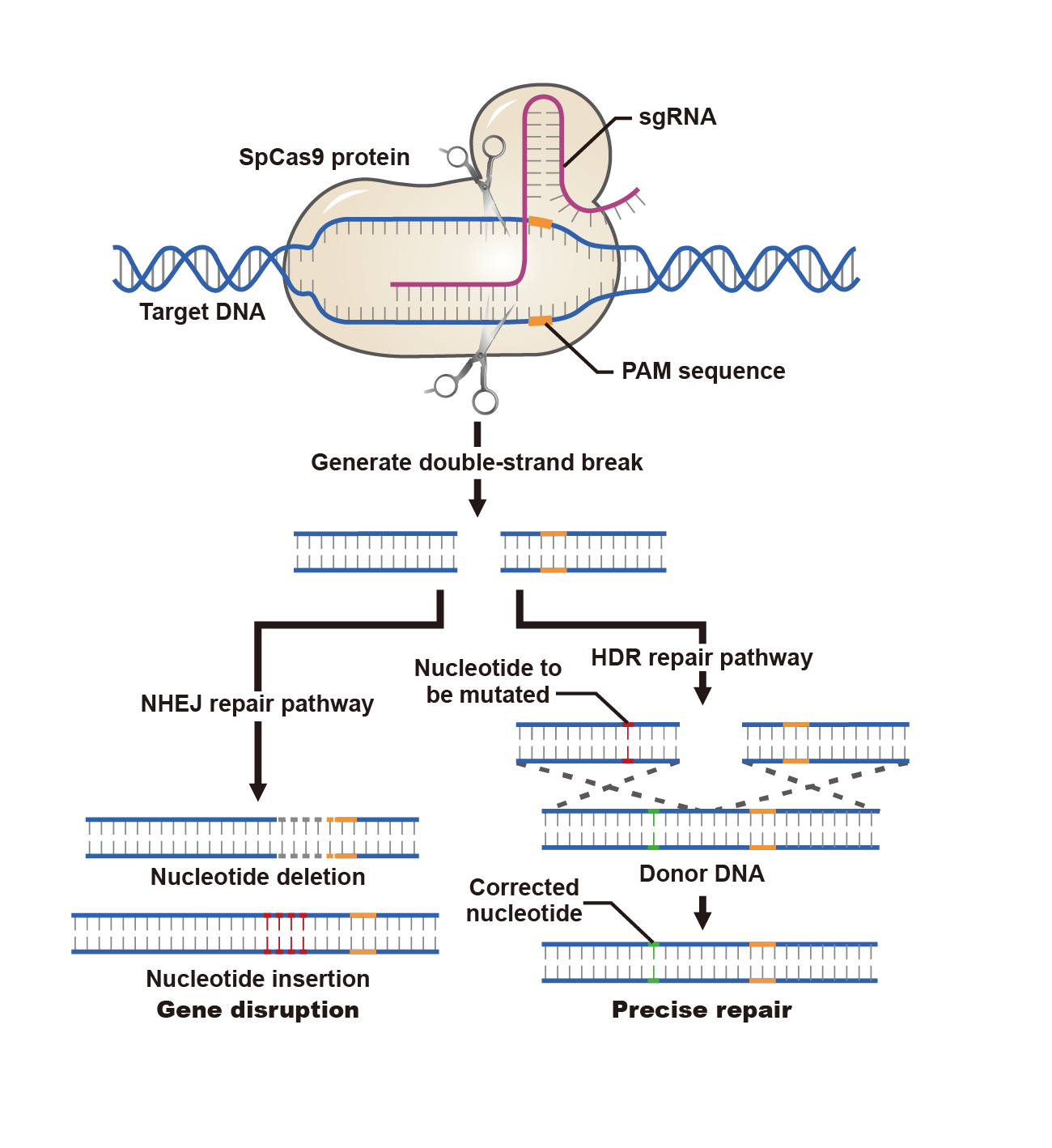
图1 CRISPR引发的DNA修复机制
>非同源末端连接(NHEJ):该种修复途径通常会引入小的插入或碱基缺失,可导致移码突变,扰乱蛋白质编码区域以及蛋白质生产过程。NHEJ可导致基因敲除,但是修复精度较差,会让被编辑细胞产生不同的细胞群。
>同源定向修复(HDR):该机制使用了一个供体DNA模板以实现更精确的DNA修复。通过使用外源供体序列,可在DSB的靶位点处引入点突变或者大片段敲入/敲除。长度<60 bp的单链寡核苷酸(ssODN)可用作小片段插入,而dsDNA可用于大片段插入(可达4-5 kb),比如荧光标签。
由于CRISPR应用的多样性,使用者需要考虑适合的Cas蛋白类型。来源于Streptococcus pyogenes 的SpCas9是最常用的Cas蛋白,其经过密码子优化可以适用于多种物种。Cas蛋白也具有除了基因敲除外的多种应用范畴,具体如下表所示:
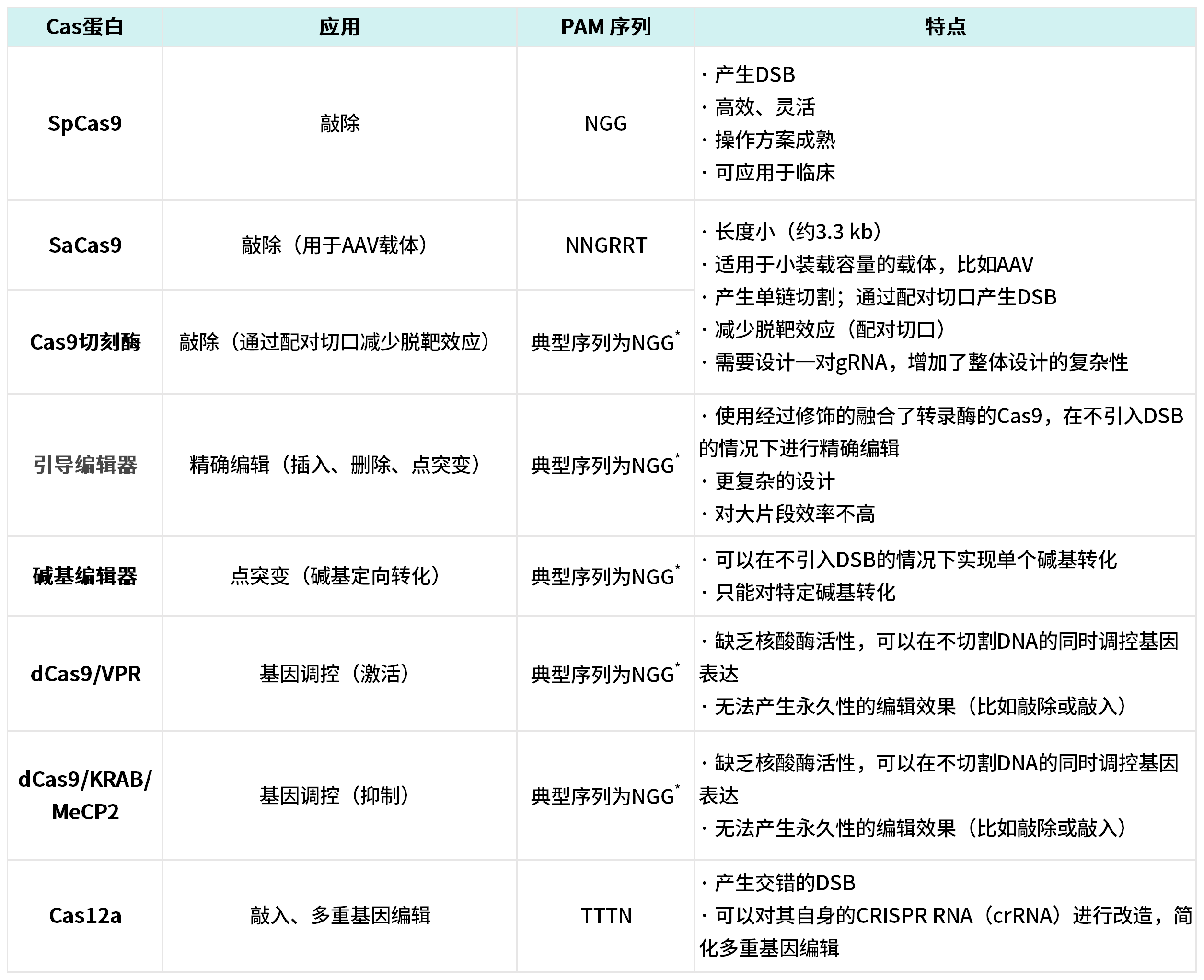
*对于Cas9切刻酶、引导编辑器、dCas9以及碱基编辑器、PAM序列通常源于基本的SpCas9系统(NGG)
根据应用和研究问题的不同,CRISPR-Cas9系统可以以反向遗传学的方式使用,该方法侧重于基因功能的研究或调控。另一方面,CRISPR-Cas9系统也可以用于制备gRNA文库,以正向遗传学的方式进行大规模基因功能筛选。通过设计靶向基因组中每个基因或特定基因集合的gRNA,可以筛选并识别与表型、通路或疾病相关的基因。
设计高效的CRISPR载体
优化CRISPR实验对于实现成功且可重复的结果至关重要,涉及选择正确的Cas9版本、目标区域、gRNA和递送方法等方面。根据我们多年的基因递送经验,以下的实用技巧可帮助您完成一个高效的CRISPR载体设计:
1. 靶位点选择:靶位点的选择取决于实验目的和应用。对于基因敲除或敲入,通常选择蛋白质编码区域(外显子)作为靶位点。对于基因调控研究,非编码调控区域(启动子、增强子、内含子等)可用作靶位点。
2. Cas9选择:选择使用哪一种Cas9会是一个关键的决定,这将确保酶的功能符合其应用目的。这种选择需要参照您的实验目的和所使用的载体系统(见上表)。
3. gRNA选择,单gRNA/双gRNA:在大多数情况下,对于简单的基因敲除,一个正确的Cas9配对单gRNA就能产生所需的表型。而对于以下的特定情况,双gRNA是更好的选择:
(1)当使用Cas9_D10A切刻酶靶向单一位点相对的两条DNA链时,需要两个gRNA共同产生DSB以减少脱靶效应;
(2)在靶位点上创建DSB并删除DSB之间的DNA片段,该DSB的创建需要一对gRNA;
(3)同时靶向两个不同的基因。
4. PAM和gRNA的兼容性:gRNA和PAM序列的选择取决于所选的Cas9版本,因为每个Cas9都需要识别特定的PAM序列。选择一个合适的PAM序列对于gRNA有效打靶和最小化脱靶效应是至关重要的。
5. CRISPR载体选择,All-in-one载体与分离的单独载体:使用CRISPR系统要实现成功的基因编辑,靶细胞必须共表达Cas9和gRNA。递送这两个组分可以使用All-in-one载体一起递送,也可以使用两个单独的载体分别递送。
All-in-one载体在一个步骤中即可递送所有必要的组分,简化了CRISPR载体的使用,有利于各组分高效的共表达。相比之下,使用分离的单独载体需要共转导,这在实验操作上更具有挑战性,因为实际转导时,一些细胞可能只接受到一个载体。然而对于使用带有标签或标记基因的修饰Cas9蛋白时,使用单独载体更为可行,因为这些修饰使用All-in-one载体时会更容易触及载体装载上限,影响转导效率。一个改进的方式是使用表达Cas9蛋白以及gRNA的细胞稳转株(无论是持续表达抑或诱导表达),尽管这将耗费更多的时间和人力。
6.报告基因系统选择:将用于筛选的标记基因(如抗生素耐药性)或荧光报告基因(如GFP、RFP)整合到CRISPR载体中将有助于识别和分离成功转导或编辑的细胞。这一步骤可以显著提高实验的效率和准确性。
7. 基因递送系统选择:递送方法因靶细胞的种类、体内的位置和应用方式而异。病毒载体(比如慢病毒或AAV)是针对难转染细胞和体内应用的理想选择,他们具有高的转导效率,并且可以选择瞬时或长期表达。然而需注意病毒载体的生产复杂,并且可能会带来更高的免疫原性和毒性。非病毒方法,比如基于脂质纳米颗粒的转染或电穿孔,实施起来更为简单,但通常与较低的递送效率相关,可能难以应用于某些细胞或组织类型。
8. HDR系统的供体DNA选择:对于使用HDR原理精确编辑,ssODN通常用于短序列的插入(<60 bp),如小型蛋白标签或点突变;而dsDNA供体则允许插入更大的序列(高达4-5 kb),例如荧光标签或报告基因。
【参考文献】
1. Sander JD, Joung JK. CRISPR-Cas systems for editing, regulating and targeting genomes. Nat Biotechnol. 2014 Apr;32(4):347-55.
2. Ran FA, Hsu PD, Lin CY, Gootenberg JS, Konermann S, Trevino AE, Scott DA, Inoue A, Matoba S, Zhang Y, Zhang F. Double nicking by RNA-guided CRISPR Cas9 for enhanced genome editing specificity. Cell. 2013 Sep 12;154(6):1380-9.
3. Cong L, Ran FA, Cox D, Lin S, Barretto R, Habib N, Hsu PD, Wu X, Jiang W, Marraffini LA, Zhang F. Multiplex genome engineering using CRISPR/Cas systems. Science. 2013 Feb 15;339(6121):819-23.
4. Ran FA, Cong L, Yan WX, Scott DA, Gootenberg JS, Kriz AJ, Zetsche B, Shalem O, Wu X, Makarova KS, Koonin EV, Sharp PA, Zhang F. In vivo genome editing using Staphylococcus aureus Cas9. Nature. 2015 Apr 9;520(7546):186-91.
5. Nan X, Campoy FJ, Bird A. MeCP2 is a transcriptional repressor with abundant binding sites in genomic chromatin. Cell. 1997 Feb 21;88(4):471-81.
6. Chavez A, Scheiman J, Vora S, Pruitt BW, Tuttle M, Iyer EP, Lin S, Kiani S, Guzman CD, Wiegand DJ, Ter-Ovanesyan D, Braff JL, Davidsohn N, Housden BE, Perrimon N, Weiss R, Aach J, Collins JJ, Church GM. Highly efficient Cas9-mediated transcriptional programming. Nat Methods. 2015 Apr;12(4):326-8.
7. Komor AC, Kim YB, Packer MS, Zuris JA, Liu DR. Programmable editing of a target base in genomic DNA without double-stranded DNA cleavage. Nature. 2016 May 19;533(7603):420-4.
8. Mushtaq M, Ahmad Dar A, Skalicky M, Tyagi A, Bhagat N, Basu U, Bhat BA, Zaid A, Ali S, Dar TUH, et al. CRISPR-Based Genome Editing Tools: Insights into Technological Breakthroughs and Future Challenges. Genes. 2021;12(6):797.