云舟生物科技(广州)股份有限公司品牌商
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
为何使用CRISPR/Cas9技术可以改进CAR-T细胞?
1184 人阅读发布时间:2023-12-01 16:00
近年来不断涌现CAR-T细胞疗法的技术创新,这种疗法正迅速成为临床上可行的癌症治疗手段。与传统化疗不同,CAR-T细胞疗法利用了患者自体的免疫细胞,并对其进行基因改造。这些经过改造的免疫细胞被回输患者体内后,可以特异性地靶向并摧毁侵袭性癌细胞。
在这篇文章中,我们将深入解析CAR-T细胞载体背后的基础生物学,并重点介绍临床应用中的CAR-T细胞疗法。我们还将详细介绍为何使用CRISPR/Cas9技术可以改进CAR-T细胞。
CAR-T细胞疗法
利用表达表面嵌合抗原受体(Chimeric antigen receptor,CAR)的工程T细胞(CAR-T)进行治疗,是当今具有革命性的癌症免疫疗法。这种方法需要对患者自身的T淋巴细胞进行基因改造,使其表面表达嵌合抗原受体。这些受体专门设计用于靶向和识别癌细胞上存在的独特标记物或抗原,一旦这些CAR-T细胞被输回患者的血液中,它们就会特异性识别癌细胞并对其发起强力的进攻。
CAR-T疗法在治疗某些类型的癌症方面取得了显着的成功,为治疗选择有限的患者带来了新的希望,并展示了利用免疫系统的天然能力来对抗癌症的技术潜力。
CAR-T疗法的关键点在于专为免疫疗法应用而设计的人工合成受体CAR。该受体由三个主要部分组成:(1)胞外抗原识别结构域,通常来源于抗体的单链可变区片段(scFv),能够与癌细胞上的靶抗原特异性结合;(2)将CAR锚定在细胞膜的跨膜结构域;(3)胞内信号域,通常源自T细胞受体复合物的CD3z链,以及一个或多个共刺激结构域,如CD28或4-1BB。这种独特的结构使得CAR-T细胞不会受传统T细胞受体(T cell receptor,TCR)与主要组织相容性复合体(Major histocompatibility complex,MHC)间的相互作用而限制,同时让CAR-T细胞针对癌细胞表现出细胞毒性。
不依赖MHC识别靶细胞是CAR-T疗法的基本优势。首先,这一特性使得该疗法适用于多种癌症类型。传统的免疫反应依赖于MHC分子呈递抗原片段,一些癌细胞可以通过下调或改变MHC表达来逃避这一机制。另一方面,CAR-T细胞被设计为直接识别细胞表面抗原,无需MHC呈递。因此,CAR-T细胞可以有效地靶向癌细胞,包括可能隐藏在免疫系统下的癌细胞。这种适应性对于对抗肿瘤的特异性至关重要,因为肿瘤内的不同细胞可能表现出不同的MHC表达水平。
AR-T细胞疗法药物Kymriah
Kymriah又称为Tisagenlecleucel,是诺华制药公司开发的一种CAR-T药物,专门用于治疗患有复发或难治性急性淋巴细胞白血病(ALL)的儿童和年轻成人患者,且用途已扩展到治疗成人弥漫大B细胞淋巴瘤(DLBCL)和成人滤泡性淋巴瘤(FL)。
Kymriah的治疗过程从采集患者血液开始,从血浆中分离出T细胞,处理后的血液回输患者,而T细胞则被冷冻保存并运送至加工设施。T细胞与免疫激活磁珠一起孵育,然后用携带CAR基因的慢病毒载体对其转导。慢病毒载体具有将转基因永-久整合到细胞基因组的机制,帮助CAR在T细胞中稳定表达。
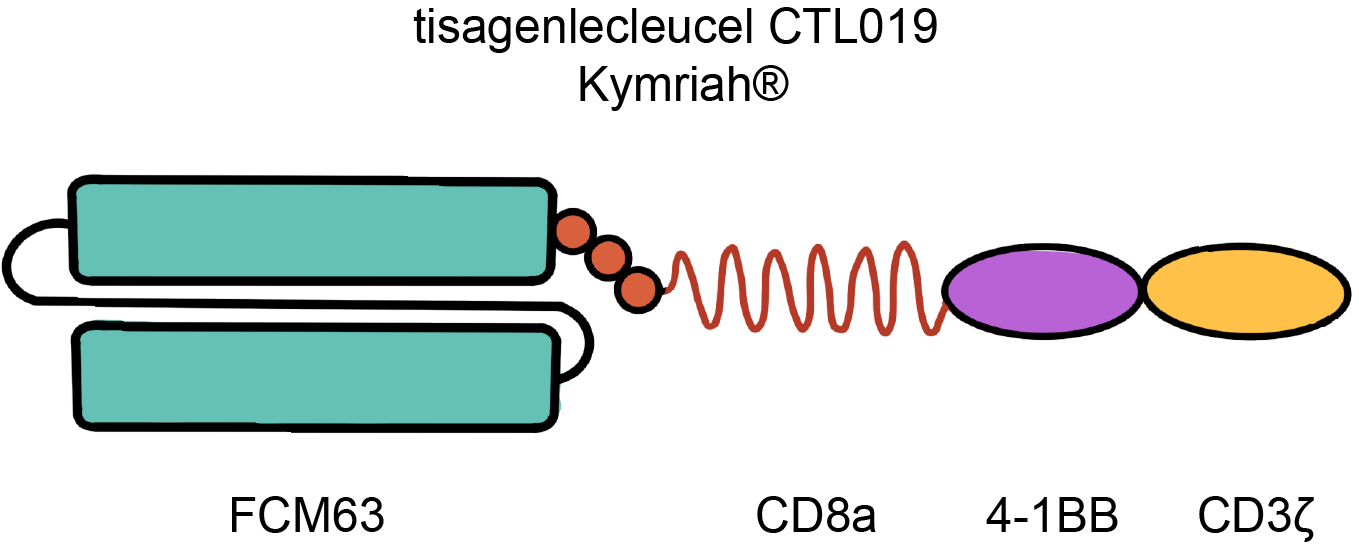
图1 Kymriah CAR分子示意图
Kymriah的临床试验结果表现良好,特别是对于复发/难治性儿童和年轻成人ALL患者。在这些试验中,Kymriah 表现出优秀的82%的总体缓解率(ORR),包括完全缓解。此外,5年无复发生存率达到了49%,这意味着无病存活期的延长和治疗效果持久。而在复发/难治性DLBCL和FL患者中,Kymriah也表现出显著的疗效,ORR分别为53%和86%。无疑,这些数据为患有血液恶性肿瘤的个体带来了新的治疗希望。
使用CRISPR技术改进CAR-T疗法
尽管CAR-T疗法取得了进步,但该疗法仍然面临着细胞在体内有限持久性的问题:T细胞耗竭现象可能导致治疗失败。此外,肿瘤微环境(特别是实体瘤)也会影响治疗效果。在工艺上,CAR-T细胞本身的扩增生产和采集自体T细胞也仍有改进的余地。使用CRISPR/Cas9基因编辑技术改造CAR-T细胞则为这些问题提供了潜在的解决方案。
CRISPR/Cas9技术可以通过在特定位点创建双链DNA断裂来实现精确的基因组编辑,该系统如今已被用于各种基因编辑实验。对于CAR-T细胞疗法,基因编辑可以用于改善T细胞功能、降低毒副作用和提高其持久性。
长时间暴露于肿瘤抗原会导致T细胞功能丧失,这就是T细胞耗竭现象。CRISPR/Cas9基因编辑提供了一种通过精确靶向PD-1和CTLA-4等抑制性受体来对抗这种耗竭的方法,帮助CAR-T细胞恢复活力并增强其治疗效果。
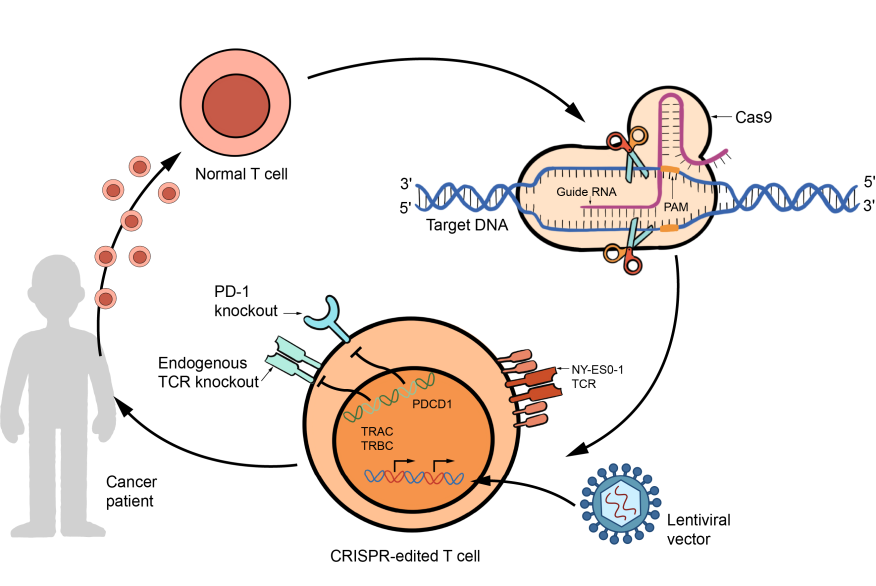
图2 CRISPR/Cas9技术在CAR-T细胞中的应用
此外,CRISPR/Cas9基因编辑还可以优化CAR-T细胞功能和安全性。通过调节细胞因子信号传导,基因编辑可以微调CAR-T细胞的激活和扩增,增强其抗肿瘤活性,同时减轻毒副作用。该技术还能够将CAR转基因精确整合到特定的基因组位置,确保CAR表达一致且受控。这种精确的基因整合可以降低CAR表达时基底信号(Tonic signaling)持续激活T细胞的风险,而这种现象通常会损害细胞功能并降低T细胞持久性。
利用CRISPR/Cas9技术创建“现成的”通用CAR-T细胞产品彻底改变了过往CAR-T细胞的生产模式。通过基因编辑改造源自健康供体的同种异体T细胞,使其避免被宿主免疫细胞排斥。这种方法简化了CAR-T细胞的制作流程,生产CAR-T细胞更简易、更具成本效益且更高效,而这也为缺乏充足自体T细胞供应的患者提供了使用CAR-T治疗的机会。
总之,CAR-T细胞疗法已成为抗击癌症的有力工具,在治疗各种恶性肿瘤方面表现出显著的疗效。Kymriah等药物的成功凸显了利用患者免疫系统精确靶向癌细胞的技术潜力。然而,整合CRISPR/Cas9基因编辑技术将是进一步增强CAR-T疗法有效性的关键。通过解决T细胞耗竭、生产效率和体内持久性等问题,CRISPR技术将促使CAR-T细胞疗法变得更容易获得、适用面更广且更有效。
参考文献
[1] Dimitri, A., Herbst, F. & Fraietta, J.A. Engineering the next-generation of CAR T-cells with CRISPR-Cas9 gene editing. Mol Cancer 21, 78 (2022).
[2] Awasthi R, Maier HJ, Zhang J, Lim S. Kymriah® (tisagenlecleucel) - An overview of the clinical development journey of the first approved CAR-T therapy. Hum Vaccin Immunother. 2023 Dec 31;19(1):2210046.