云舟生物科技(广州)股份有限公司品牌商
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
科研赋能丨云舟生物助力澳门大学发现减少三阴性乳腺癌转移的新策略
799 人阅读发布时间:2023-12-05 17:01

三阴性乳腺癌
乳腺癌已成为全球最常见的癌症,三阴性乳腺癌是其中风险最高的一种亚型,约占所有乳腺癌的15%-20%。三阴性乳腺癌,即雌激素受体(estrogen receptor, ER)、孕激素受体(progesterone receptor, PR)和人表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)的表达缺失而呈现阴性的乳腺癌。
TNBC患者的五年死亡率为42%,远高于非TNBC患者28%的平均5年死亡率。这种高死亡率主要是由于TNBC细胞的转移能力较强所致。癌细胞要生长成原发性肿瘤并转移成继发性肿瘤,必须克服免疫细胞的攻击,包括巨噬细胞、自然杀伤(NK)细胞和细胞毒性T淋巴细胞。
越来越多研究表明,TNBC肿瘤比非TNBC肿瘤拥有更多的巨噬细胞浸润,从而促进了TNBC细胞转移。然而,关于TNBC细胞与巨噬细胞相互作用后如何恶化的研究较少。因此,了解TNBC细胞如何克服巨噬细胞攻击,利用巨噬细胞获得转移能力,对TNBC的治疗和延长TNBC患者的寿命具有重要意义。
研究介绍
澳门大学健康科学学院罗茜教授等人的团队通过研究TNBC细胞与巨噬细胞相互作用后驱动肿瘤恶化的过程,发现TNBC细胞在与巨噬细胞共培养后获得更强的转移能力,表明降低ROS或下调IL1α可作为减少TNBC转移的新策略,并于今年8月在《Advanced Science》杂志(影响因子:15.1)发表了题为“The Interaction between Macrophages and Triple‐negative Breast Cancer Cells Induces ROS‐Mediated Interleukin 1α Expression to Enhance Tumorigenesis and Metastasis”的文章。
研究团队将各种类型的癌细胞与巨噬细胞共培养,发现与非TNBC细胞相比,TNBC细胞在与巨噬细胞共存时活性更好。更重要的是,在与巨噬细胞共培养后,TNBC细胞的转移能力得到增强。随后,研究团队进行了RNA测序(RNA-seq)分析,并通过敲低、敲除候选基因等方式确定TNBC细胞的驱动基因,发现IL1α、IL1β、IL8的上调会使TNBC细胞在与巨噬细胞相互作用时能够存活,并获得更强的转移和肿瘤生长能力。
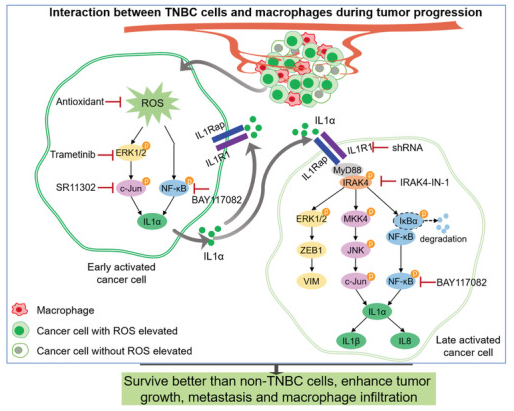
肿瘤进展过程中TNBC细胞与巨噬细胞之间的相互作用
进一步研究发现,在肿瘤微环境中,一些早期活化的TNBC细胞会与巨噬细胞相互作用以提高ROS水平,从而激活ERK1/2-c-Jun和NF-κB信号通路导致IL1α表达增加。当IL1α分子从细胞中分泌出来时,它们可以与自身或邻近的晚期活化TNBC细胞的受体IL1R1结合,以激活三种下游信号通路:①ERK1/2-ZEB1-VIM;②MKK4‐JNK‐c‐Jun;③NF-κB。这些通路会进一步增加IL1α、IL1β和IL8的表达,以提升TNBC与巨噬细胞相互作用时的存活率,并增强肿瘤生长,促进TNBC转移和巨噬细胞浸润到肿瘤部位。
该研究确定了IL1α可增加 TNBC细胞的恶性程度,使用抗氧化剂减少IL1α的生成可能是减少TNBC转移的良好策略。基于IL1R1在肿瘤进展中的作用,研究团队提出,通过使用IL1α或IL1R1抗体来阻止IL1α及其受体的结合可能是减弱TNBC恶性程度的新治疗策略。此外,IL1α可以作为诊断更具侵袭性的TNBC的潜在标志物。
云舟生物为澳门大学研究团队提供助力
云舟生物为澳门大学健康科学学院罗茜教授等人的团队提供了该研究所用的全部shRNA(shIL1α、shIL1β、shIL8、shIL1R1、shCXCL1、shCXCL2、shCXCL3、shCCL20、shC3)和过表达载体(IL1),助力研究团队发现TNBC细胞与巨噬细胞相互作用后驱动肿瘤恶化的机制,为治疗TNBC提供了新思路。
就本次澳门大学研究所采用的shRNA基因敲低和过表达解决方案,云舟生物助力其获得了高效的表达效果。其中,综合多样化的shRNA基因敲低解决方案是云舟生物的特色服务之一,基于U6启动子驱动的shRNA的和自定义启动子驱动的miR30 shRNA这两种shRNA表达方式,云舟生物可根据具体的实验需求灵活控制shRNA的表达。
云舟生物可以对shRNA载体进行多种类型多种滴度的病毒包装(如慢病毒、AAV、腺病毒),可助力用户将shRNA递送至难以转染的细胞中。云舟生物还可以专门为哺乳动物细胞中的大规模基因功能丧失筛选构建shRNA文库。
此外,云舟生物的基因载体在线设计平台“VectorBuilder(载体家)”与shRNA数据库涵盖了多种物种,让用户可以轻松找到合适的shRNA打靶目的基因。
云舟生物作为引领全球基因递送技术的创新型企业,可提供丰富多样的病毒和非病毒的基因载体递送系统,如腺相关病毒(AAV)载体、腺病毒载体(包括gutless腺病毒)、慢病毒(Lentivirus)载体、莫洛尼氏鼠白血病病毒(MMLV)载体、昆虫杆状病毒载体、水疱性口炎病毒(VSV)载体、单纯性疱疹病毒(HSV)载体、PiggyBac载体和睡美人载体等。这些载体能够满足几乎所有模式生物中的各种应用,例如过表达、shRNA干扰、CRISPR、重组蛋白表达以及体外转录等。
【参考文献】
Hao M, Huang B, Wu R, Peng Z, Luo KQ. The Interaction between Macrophages and Triple-negative Breast Cancer Cells Induces ROS-Mediated Interleukin 1α Expression to Enhance Tumorigenesis and Metastasis. Adv Sci (Weinh). 2023 Oct;10(29):e2302857. doi: 10.1002/advs.202302857. Epub 2023 Aug 8. PMID: 37551997; PMCID: PMC10582438.
【论文链接】
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10582438/