云舟生物科技(广州)股份有限公司品牌商
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
深入解析荧光蛋白、荧光素酶和β-半乳糖苷酶报告基因,助您实验无忧
1650 人阅读发布时间:2024-04-29 09:47
在分子生物学实验中,报告基因的表达因其易于被检测的特点,被广泛用于研究目的基因的表达或调控区域的活性水平,而这些生物学机制通常很难直接测量。对于不同类型的报告基因,荧光蛋白、荧光素酶和β-半乳糖苷酶是生物研究中最常用的几种类型。
选择使用哪种报告基因很大程度上取决于研究所需要的数据是定量的还是定性的,以及是需要处理活细胞还是固定组织等场景。本文将深入解析这三种报告基因的特点和应用场景,以帮助研究者在实验中正确选择合适的报告基因。
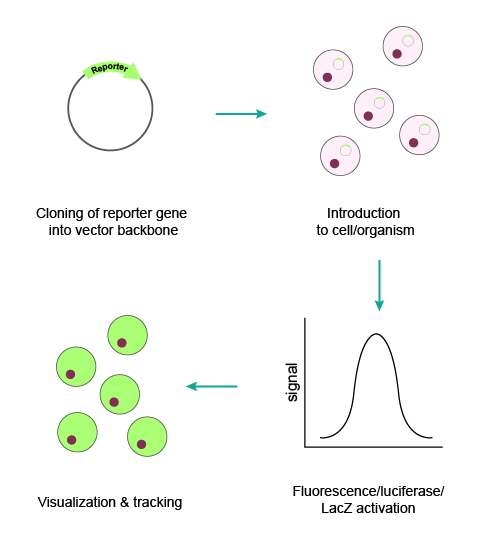
图1 典型的报告基因递送流程
让报告基因进入细胞的递送方式多种多样,一般而言可使用质粒载体、病毒载体或者IVT mRNA载体进行递送。此外,对于很多实际研究中的问题,将报告基因放在载体中的不同位置可以提供有效的解决方案:
Q:启动子在特定组织或细胞中的活性不明确?
A:将报告基因放在组织/细胞特异性启动子的下游进行表达。
Q:药物处理后,GOI表达水平变化如何测量?某些GOI自身的表达水平无法直接测定?
A:将报告基因通过连接子的方式与GOI一同克隆至表达载体。
Q:如何测量启动子的强度?
A:将一个可定量分析的报告基因克隆至该启动子的下游进行表达。
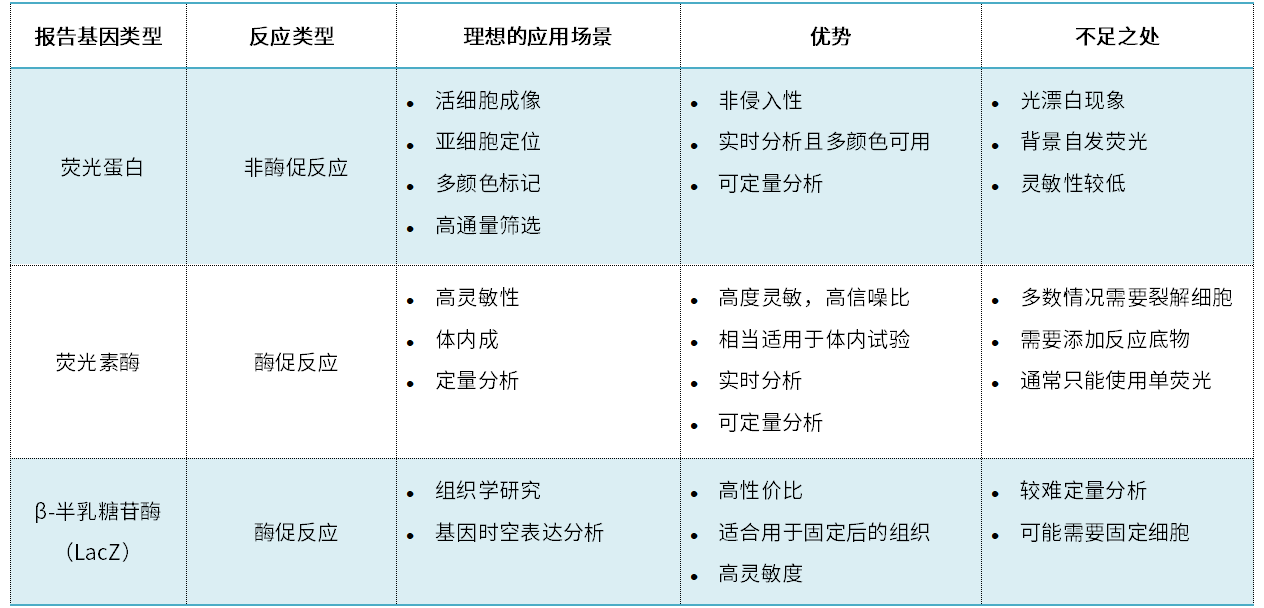
荧光蛋白
从水母中发现并分离出的绿色荧光蛋白(GFP),在分子生物学的发展史中具有重要意义。GFP可以在各种真核生物细胞中成功折叠形成有功能性的荧光蛋白,并且这种荧光可以被荧光显微镜轻松观察到,因此被用于各种基因表达、亚细胞定位以及细胞过程的标记。自GFP被发现以来,其他几种荧光蛋白也陆续被发现并用于生物研究。这其中包括能产生红光的红色荧光蛋白(RFP)和mCherry、作为 GFP衍生物的黄色荧光蛋白(YFP),以及蓝色荧光蛋白(BFP)家族的成员 TagBFP2。
荧光蛋白是一种理想的报告基因系统,因为它们能让人实时了解活细胞和生物体的细胞和分子机制。此外,荧光蛋白有多种颜色,可同时显示多种细胞成分,有利于研究多个靶标,而 LacZ 和荧光素酶通常仅能呈递单一信号。但是另一方面,荧光蛋白容易发生光漂白(暴露在光线下会失去荧光),也可能会有自发荧光现象,因此在某些情况下其使用也会受到限制。
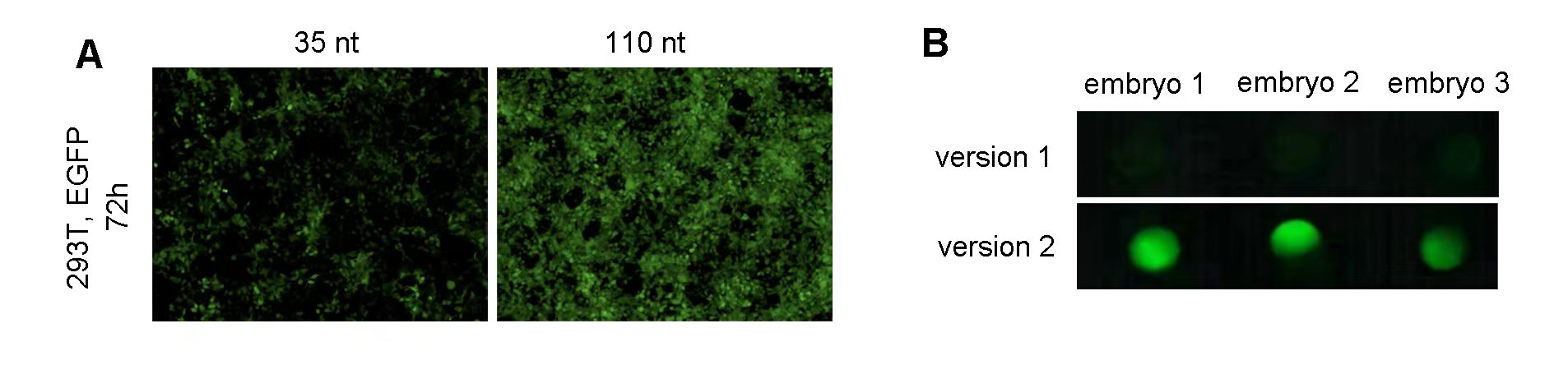
图2 (A)1 ug斑马鱼 EGFP mRNA转染293T细胞。细胞生长于12孔板。转染后72 h结果表明拥有110 nt的polyA尾巴的EGFP mRNA体外表达效果更佳。(B)使用250 pg斑马鱼EGFP IVT mRNA显微注射单细胞期斑马鱼胚胎,注射后6 h筛选EGFP表达效果。荧光图像表明含有经过优化的Kozak序列的mRNA(version 2)在体内表达效果更佳。
荧光素酶(Luciferase)报告基因
对生物发光的科学研究始于20世纪初对发光生物的实验,并最终发现生物发光是一种包含了荧光素酶和底物的化学反应,表明这类荧光是可以定量分析的。荧光素酶试验是一种相当常用的报告基因,它可以反应转基因表达水平。荧光素酶试验中的生物发光是荧光素酶活性的直接读数;荧光素酶在 ATP和氧气的存在下作用于特定底物——荧光素。氧化了的荧光素发出的光可以用荧光计测量。光强度与荧光素酶的含量成正比,并可作为量化基因表达水平的精确数值。
荧光素酶的一大优势是背景信号极小,可提供高灵敏度的定量分析。不过,这种检测方法需要在反应中加入底物,而且这种信号具有瞬时性,使其无法用于长期的跟踪标记。
荧光素酶序列自身可以被高度优化,比如进行密码子优化。云舟生物优化后的HiExpressTM萤火虫荧光素酶IVT mRNA表现出高水平的基因表达。
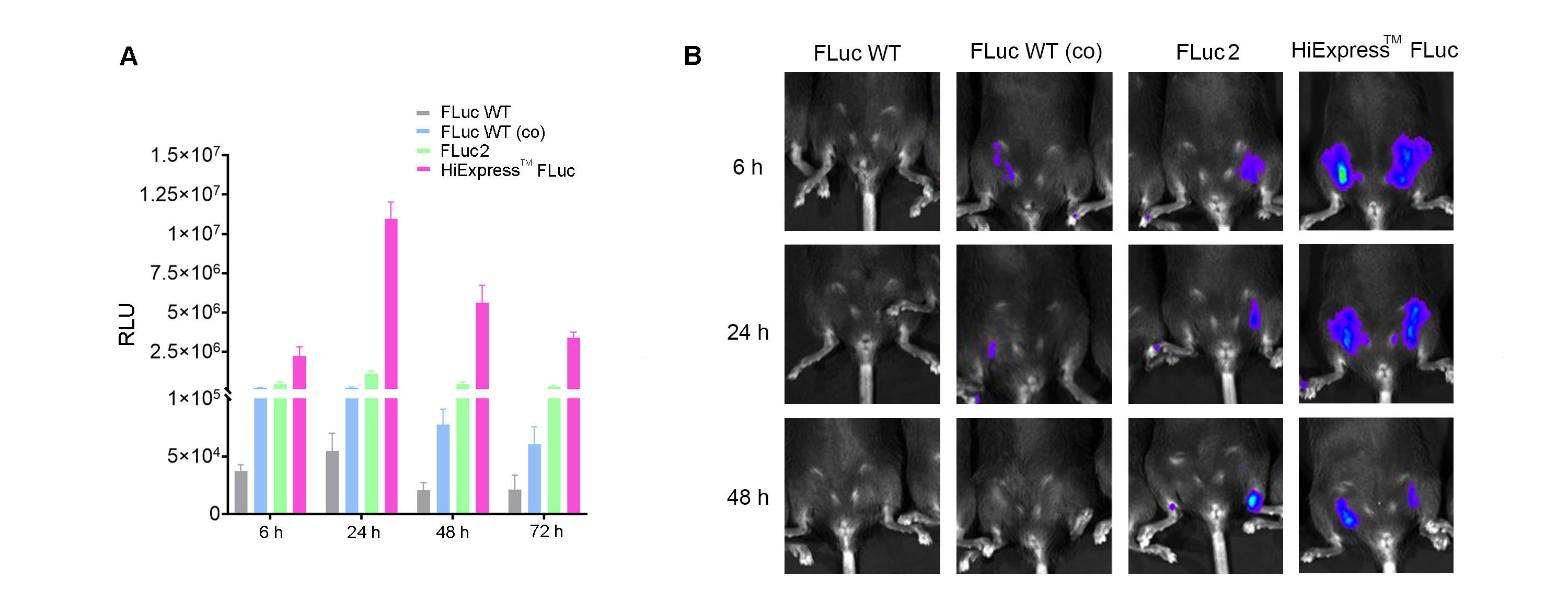
图3 (A)HEK293T细胞中表达HiExpressTM萤火虫荧光素酶IVT mRNA以及其它版本的荧光素酶mRNA。细胞生长于12孔板,每孔转染0.5 ug mRNA。转染后6 h、24 h、48 h以及72 h测定荧光素酶活性。(B)向C57BL/6成年小鼠肌肉注射30 ug LNP包封的荧光素酶mRNA,注射后6 h、24 h、48 h测定荧光素酶活性。Fluc WT表示野生型荧光素酶mRNA。Fluc WT (co)表示经过密码子优化的荧光素酶mRNA。Fluc2表示luc2荧光素酶mRNA。HiExpressTM Fluc表示云舟生物HiExpressTM萤火虫荧光素酶IVT mRNA。
β-半乳糖苷酶/ LacZ报告基因系统
LacZ基因编码大肠杆菌乳糖代谢所需的β-半乳糖苷酶(β-gal),一种早期研究转录调控过程所发现的关键酶。LacZ基因被深入研究后广泛用作生物研究中的报告基因。β-gal是一种四聚体酶,通常能分解乳糖,但当它作用于乳糖衍生物X-gal 时,反应的副产物会呈现出易于识别的蓝色,因此可用于检测酶活。在宿主细胞中加入X-gal,就可以很容易地通过识别蓝色产物监测β-gal的表达。LacZ系统主要用于克隆实验中重组细菌阳性克隆的鉴定,以及各种生物体内启动子活性的测量。此外,通过将GOI与lacZ基因融合,还可以用于研究蛋白质定位、蛋白质之间的相互作用以及载体元件(比如响应Cre的FLEX元件)对基因表达的影响。
β-gal/Lac-Z是一种性价比很高的系统,具有很高的信噪比,可以检测低水平的基因表达。这种系统可应用的物种范围非常广泛,包括从细菌到哺乳动物细胞的各种生物。此外。这种酶没有毒性,可用于在细胞和整个生物体内的基因表达研究。不过,在活细胞和生物体中进行β-gal检测比较复杂,许多实验需要裂解细胞或固定细胞/生物组织。此外,与荧光蛋白或荧光素酶检测相比,这种检测方法的结果较难进行定量分析。
需要提及的是,不同的报告基因也可以在实验中一同使用——通过利用每种报告基因系统的独特优势获取更全面的生物体信息。比如可以将这些报告基因用于不同的细胞区室从而进行更精确的定位研究(一种报告基因用于细胞核,另一种用于细胞质)。同时使用这些报告基因需要精心的实验设计,以避免发生交叉干扰影响实验结果的准确性。
参考文献
1. Kremers, Gert-Jan, Sarah G. Gilbert, Paula J. Cranfill, Michael W. Davidson, and David W. Piston. 2011. "Fluorescent Proteins at a Glance." Journal of Cell Science 124 (2): 157–160.
2. Chudakov, Dmitriy M., Mikhail V. Matz, Sergey Lukyanov, and Konstantin A. Lukyanov. 2010. "Fluorescent Proteins and Their Applications in Imaging Living Cells and Tissues." Physiological Reviews 90 (3): 1103–1163.
3. Cranfill, P., B. Sell, M. Baird, et al. 2016. "Quantitative Assessment of Fluorescent Proteins." Nature Methods 13: 557–562.
4. Yeh, H.W. and H.W. Ai. 2019. "Development and Applications of Bioluminescent and Chemiluminescent Reporters and Biosensors." Annual Review of Analytical Chemistry (Palo Alto, Calif) 12 (1): 129–150.
5. Zambito, Giorgia, Chintan Chawda, and Laura Mezzanotte. 2021. "Emerging Tools for Bioluminescence Imaging." Current Opinion in Chemical Biology 63: 86–94. ISSN 1367-5931.
6. Sharma, Shiv K., Sijan Poudel Sharma, and Roger M. Leblanc. 2021. "Methods of Detection of β-galactosidase Enzyme in Living Cells." Enzyme and Microbial Technology 150: 109885. ISSN 0141-0229.
7. Sedzro, DM, SMF Bellah, H Akbar, and SMS Billah. 2018. "Structure, Function, Application and Modification Strategy of β –Galactosidase." Journal of Multidisciplinary Research Review 1 (1): 10–16.