云舟生物科技(广州)股份有限公司品牌商
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
CRISPR基因递送系统指南(下)
789 人阅读发布时间:2025-03-06 13:27
病毒载体凭借高效递送CRISPR组分的优势,成为基因治疗研究的重要工具,尤其适用于转染难度较高的分化细胞。不同病毒类型还可实现高效的体内递送,但其生产工艺复杂、成本较高,限制了广泛应用。与质粒相比,病毒载体生产需额外步骤:先将CRISPR组分克隆至转移载体,再包装成病毒颗粒,这种劳动密集型的特性也增加了规模化生产的难度。
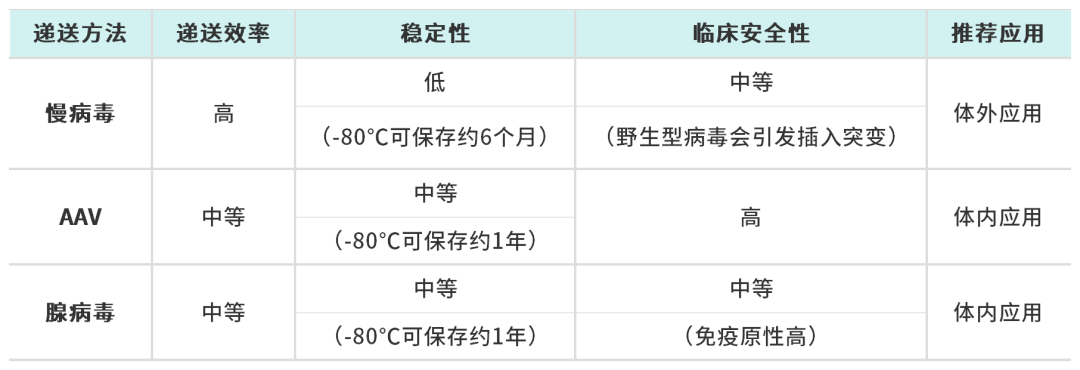
目前主流的CRISPR递送载体包括慢病毒、腺相关病毒(AAV)和腺病毒,它们在转导效率、免疫原性、载体容量等方面各具特点,需根据实验目标选择适用类型。
基于慢病毒的递送方式
慢病毒凭借与电穿孔相当的基因递送效率,成为CRISPR组分递送的热门工具,尤其适用于大规模CRISPR文库筛选。其优势在于可将转基因整合至宿主基因组实现长期表达,这对过表达实验具有重要价值。但基因组整合特性带来的插入突变风险,限制了其在临床体内应用,目前主要应用于基础研究及体外基因修饰,例如FDA已批准的CAR-T癌症疗法和治疗β-地中海贫血症的Zynteglo。
需注意的是,慢病毒递送CRISPR时Cas9的持续表达可能引发脱靶效应,而可诱导表达系统或整合酶缺陷型慢病毒(IDLV)可有效缓解这一问题——IDLV将基因组整合率降低约500倍。虽然其转导效率低于常规慢病毒,但在体外和体内神经元中的递送效率与常规载体相当,这为中枢神经系统疾病的治疗提供了独特潜力。
基于AAV的递送方式
该体系当前面临两大技术瓶颈:首先是载体容量限制(约4.2kb),远低于慢病毒载体的装载能力;其次是转导效率相对较低。针对容量问题,研究者开发了多重解决方案:
①采用序列长度较小的SaCas9);
②双载体共递送策略(分别装载Cas9与gRNA);
③SpCas9分割表达技术,通过两个载体递送SpCas9片段在细胞内形成完整的SpCas功能蛋白。
值得注意的是,AAV系统具备独特的临床优势:多样化的血清型选择可实现组织特异性靶向,结合衣壳定向进化技术(通过体外/体内筛选优化衣壳蛋白),可进一步提升递送精准度和治疗效果。
尽管目前尚无基于AAV的CRISPR疗法获得FDA批准,但AAV平台已成功应用于其他基因药物。例如治疗脊髓性肌萎缩的Zolgensma®,其商业化应用为CRISPR-AAV疗法的临床转化提供了重要参考。
基于腺病毒的递送方式
基于腺病毒的基因递送系统在安全性方面表现突出,其非整合特性已通过多项临床试验验证,成为替代慢病毒的重要选择。相较于AAV和慢病毒载体,腺病毒具有显著扩增的装载能力,但高免疫原性可能干扰基因编辑效果。目前临床应用最广的Ad5血清型依赖CAR受体介导细胞转导,这限制了其组织适用性。最-新研发的Ad5/F35嵌合体成功突破CAR受体依赖性,同时gutless腺病毒载体(仅保留必要包装序列)不仅将降低了免疫原性,而且扩大了载体容量(可达33 kb),非常适合表达长的或多个转基因。
在临床转化方面,腺病毒载体已展现多重突破:
①遗传病领域:EBT-101作为首-个静脉注射型CRISPR-HIV治疗载体,已启动I/IIa期临床试验;
② 肿瘤治疗:多项临床前研究证实其在实体瘤靶向中的优势。
值得注意的是,虽然FDA已批准首-款腺病毒基因疗法,但基于CRISPR的腺病毒疗法还在临床实验阶段。