云舟生物科技(广州)股份有限公司品牌商
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
告别抗生素残留风险:MiniVec™平台实现更安全、高效的GMP级生产
221 人阅读发布时间:2025-11-28 10:21
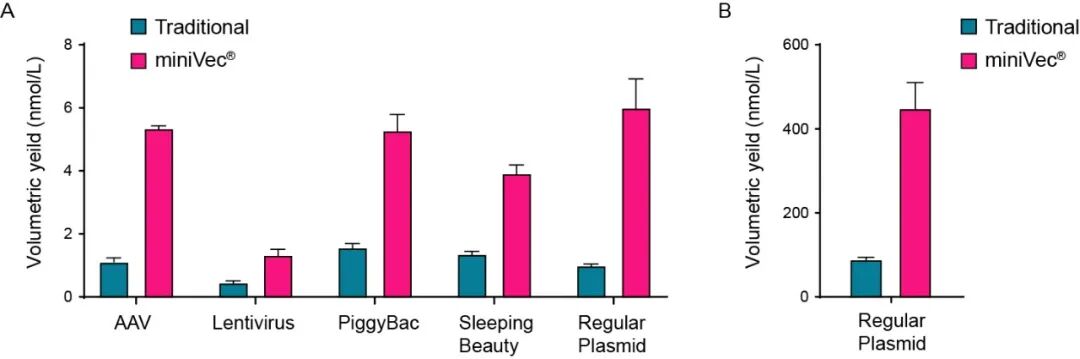
VectorBuilder独有的MiniVec™质粒提供了一种微型载体骨架,能够赋予基因医学、疫苗制剂以及食品技术等相关领域的应用更为卓越的效力、安全性与可生产性。VectorBuilder此前已进行验证,相较于传统质粒,MiniVec™质粒不仅可带来更高的质粒生产产量以及转基因表达水平,还可提升多种应用场景,如病毒包装、CRISPR基因编辑、转座子递送等下的实验表现及其安全性。
MiniVec™质粒仅可在专门的miniHost™细菌宿主菌株中发挥作用。这种经过工程改造的E. coli 菌株包含一个位于SeqA序列下游的生长抑制因子基因,以及一个编码解毒蛋白的基因。该解毒蛋白通过中和生长抑制因子的作用从而促使细胞增殖。在培养基中添加特定的添加剂可诱导该解读蛋白的表达,从而中和生长抑制因子的并以此促使细胞增殖。
当从培养体系中移除诱导添加剂并将MiniVec™质粒转化至miniHost™细胞后,一个由MiniVec™质粒所携带的SeqB基因将转录产生一种与生长抑制因子转录本SeqA区域互补配对的小非编码RNA。该小非编码RNA通过抑制生长抑制因子的翻译过程以促进细胞增殖。此时,只有成功转化的宿主细胞才能大量增殖,从而产生高拷贝数的MiniVec™质粒。
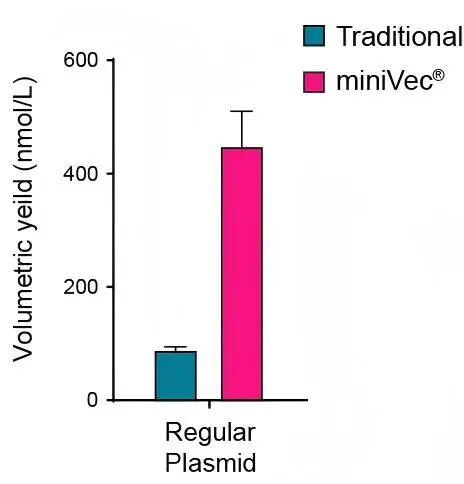
除了在实验室使用,MiniVec™在工业规模的发酵条件下也可显著改善了质粒生产的产量。这种显著的提升效果可归因于几个关键机制,其中包括偏好携带高拷贝质粒宿主菌的发酵过程、更高效的质粒复制以及更低的代谢负担。 为验证MiniVec™质粒对工业规模发酵的使用效果,我们将传统质粒或MiniVec™质粒以同等条件转化E. coli,测定工业规模(2.7 L)下E. coli 培养物发酵所得的质粒产量(下图)。
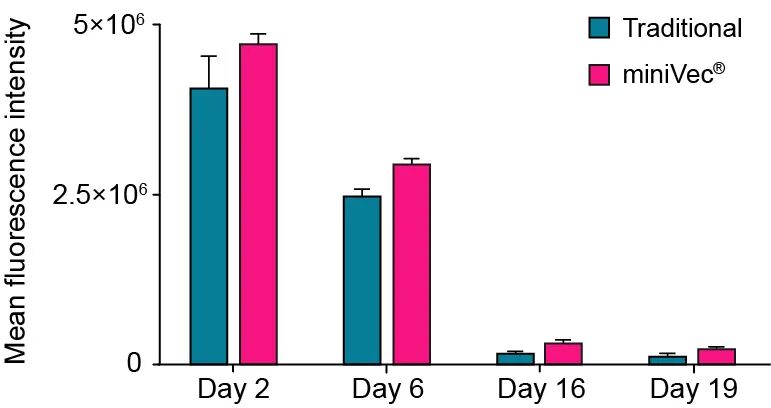
此外,经过验证(下图),我们发现运用MiniVec™可提升CRISPR基因组编辑效率。向HEK293T细胞以相同摩尔量共转染hCas9质粒载体(基于传统质粒或MiniVec™质粒)和表达EGFP的供体质粒载体,通过同源非依赖性靶向插入(HITI)检验EGFP基因在基因组AAVS1位点的整合效率。通过流式细胞术测量指定时间点的细胞平均荧光强度,直至对照组(未展示)中荧光不可见。
MiniVec™质粒所带来的这种基因递送效率提升在体内应用中也得以体现。在疫苗递送模型中,注射MiniVec™质粒可以成功激活急性和长期免疫应答。所有体内实验均未表现出任何机体或生理层面的不良反应,MiniVec™在基因治疗和疫苗应用领域的具有良好的可用性。
为了验证MiniVec™质粒用于疫苗递送的效果,我们使用裸DNA免疫法对比传统质粒与MiniVec™质粒在表达COVID-19刺突蛋白时所诱导的免疫应答。分别向BALB/c小鼠肌肉注射三次,每次间隔两周的等摩尔量传统疫苗或MiniVec™疫苗、阴性对照(PBS)以及溶剂对照(传统空质粒或MiniVec™空质粒)。
(A)在每次接种的两周后,下次免疫前,对动物采血检测特异性抗体效价。实验第42天,采集脾细胞。脾细胞培养物上清液用于检测由刺突蛋白免疫激活的(B)总IFN-γ分泌水平。
总体而言,MiniVec™质粒表现出显著改善的且可靠的安全性特征。VectorBuilder创新的MiniVec™平台消除了潜在的抗生素残留风险,降低了基因水平转移风险,并能确保最终产品的纯度。在药品 GMP 生产中,相较于传统依赖抗生素的质粒, MiniVec™提供了一种更安全、更可靠的替代方案,其卓越的安全性在动物实验中也得到了验证。接受MiniVec™质粒注射后的动物,经过毒理学分析发现未对动物健康产生任何不良反应,而MiniVec™空载体也未引发任何免疫反应。特别值得一提的是,该系统的设计准则完全符合FDA和EMA制定的治疗药物生产监管标准。