云舟生物科技(广州)股份有限公司品牌商
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
论文详解 | MiniVec™如何突破传统质粒的抗生素依赖与功能瓶颈?
1189 人阅读发布时间:2025-12-25 10:46
质粒是现代分子生物学和基因工程中最常用的基因载体,广泛应用于基础研究、药物研发及临床治疗。然而,传统质粒骨架通常携带抗生素抗性基因(ARG),尽管这确保了质粒在细菌中的扩增,但同时也带来了多重安全隐患:水平基因转移可能促生“超级细菌”,残留的抗生素成分可能引发患者过敏反应;同时,ARG本身也增加了宿主细胞的代谢负担,限制了质粒的产量及其各种应用中的效能。
此外,当质粒进入真核系统时,还可能引发目的基因沉默或免疫反应。现有改进方案存在各自局限,例如需要添加蛋白编码序列、依赖化学添加剂、制造工艺复杂、产量偏低等。因此,开发一种更安全、高效且易于生产的质粒骨架成为亟待解决的关键问题。
在此背景下,云舟生物独-家推出MiniVec™质粒系统,并联合广州未来基因递送研究院对其设计原理与功能性能进行了系统验证。相关研究成果已发表于bioRxiv预印本论文《MiniVec: A Compact and Antibiotic-Free Plasmid Backbone for Enhanced Biomanufacturing and Therapeutic Applications》,论文中详细阐述了该系统的设计、功能表现和应用优势。

MiniVec™的设计原理与构建策略
MiniVec™是一种无抗生素、无化学添加剂、无蛋白质编码序列的极简质粒系统。它通过小RNA与特定工程宿主MiniHost的协同调控,在无抗生素环境下实现质粒的稳定维持。
MiniVec™骨架的核心仅包含复制起点(Ori)和小RNA基因(SeqB),完全不含任何蛋白质编码序列,最短长度约500bp。其专用宿主MiniHost基因组携带含SeqA序列的生长抑制基因(如ccdB)及可被化学添加剂诱导的抗毒素基因(如ccdA)。
在无MiniVec™的情况下,MiniHost需依赖添加剂诱导抗毒素表达以中和生长抑制剂;转入MiniVec™后,SeqB小RNA可通过与生长抑制基因mRNA的SeqA区域互补结合及形成二级结构,抑制生长抑制剂翻译,使MiniHost正常增殖。由此,只有携带MiniVec™的菌株可存活,从而实现无需抗生素的高效筛选与质粒维持。
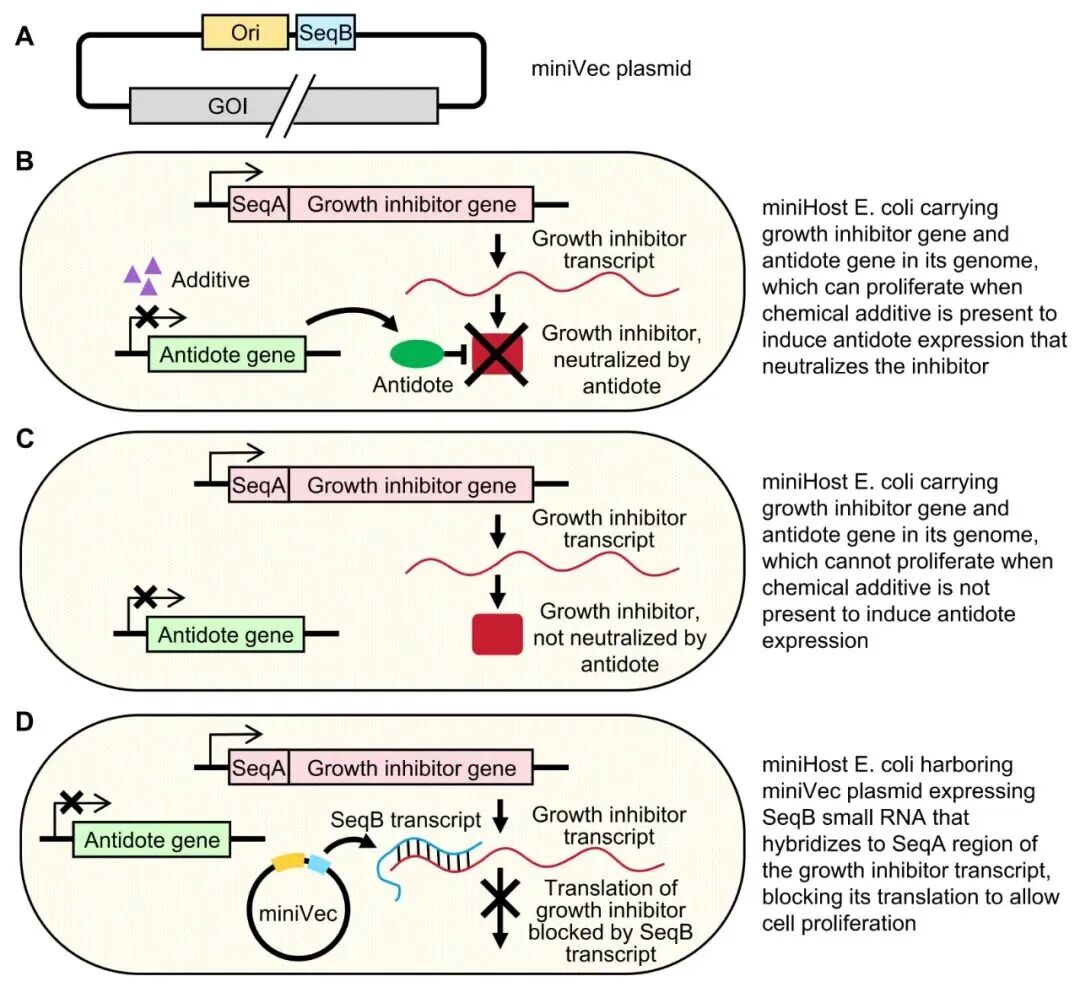
图1 在经特殊工程改造的大肠杆菌宿主MiniHost中,MiniVec™质粒通过无抗生素、无添加剂方式进行筛选的示意图
同时,研究团队已成功构建多种MiniVec™衍生质粒,覆盖不同大小、GC含量及功能类型(包括蛋白编码基因与小RNA表达载体)。实验显示,MiniVec™体系的克隆效率与传统抗生素质粒相当,并已实现全长达34,865 bp的腺病毒包装质粒的稳定构建,验证了其卓越的通用性与可扩展性。
MiniVec™的长期稳定性验证
为评估MiniVec™的遗传稳定性,研究团队将3种MiniVec™质粒(AAV EGFP转移质粒、VSV-G表达质粒、慢病毒GagPol表达质粒)在MiniHost中连续传代15天(约250次倍增)。结果显示:
• 在第11天和第15天分别挑取的共384个单菌落中,质粒保留率达100%;
• 对第15天的菌落样本进行全长测序,序列与初始参考序列完全一致。
这些结果充分证明,MiniVec™系统在长期传代中具备极高的结构稳定性与遗传一致性,可支持高强度生产与持续应用。
MiniVec™质粒的DNA产量优势
在实验室摇瓶培养中,研究团队对比了5种插入片段(AAV EGFP转移质粒、慢病毒EGFP转移质粒、PiggyBac/SleepingBeauty转座子、过表达载体)的MiniVec™与传统质粒。结果显示:
• MiniVec™产量显著更高,其中PiggyBac EGFP转座子质粒平均产量达10.97 mg/L,为传统质粒的1.9倍;
• 按拷贝数计算,MiniVec™版本平均产量为5.28 nmol/L,是传统版本的3.4倍;
• 在工业规模(2.7 L发酵)测试中,MiniVec™过表达载体的产量高达1855.37 mg/L,为传统质粒的4–5倍。
这些结果表明,MiniVec™不仅在实验室条件下具备高复制效率,在中试与工业化生产中同样具备显著的产量优势,为生物制药与基因治疗载体的大规模制造奠定了坚实基础。
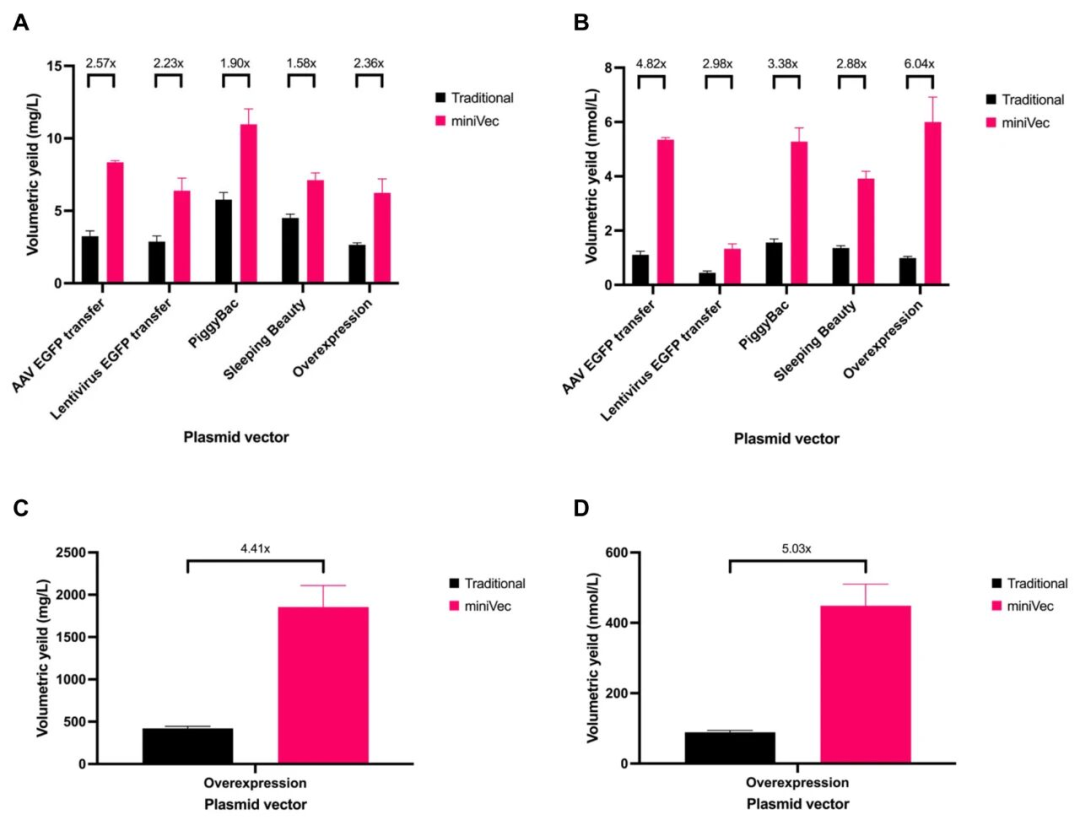
图2 MiniVec™质粒与传统质粒的DNA产量对比
MiniVec™在多种场景中的功能增强表现
瞬时转染效率:在HEK293T细胞中以等摩尔量转染含EGFP过表达盒的MiniVec™,与传统质粒相比,48 h和96 h荧光成像显示MiniVec™组EGFP表达更高;流式细胞分析表明,虽然荧光阳性细胞比例相近,但MiniVec™组平均荧光强度(MFI)比传统质粒高30%以上。
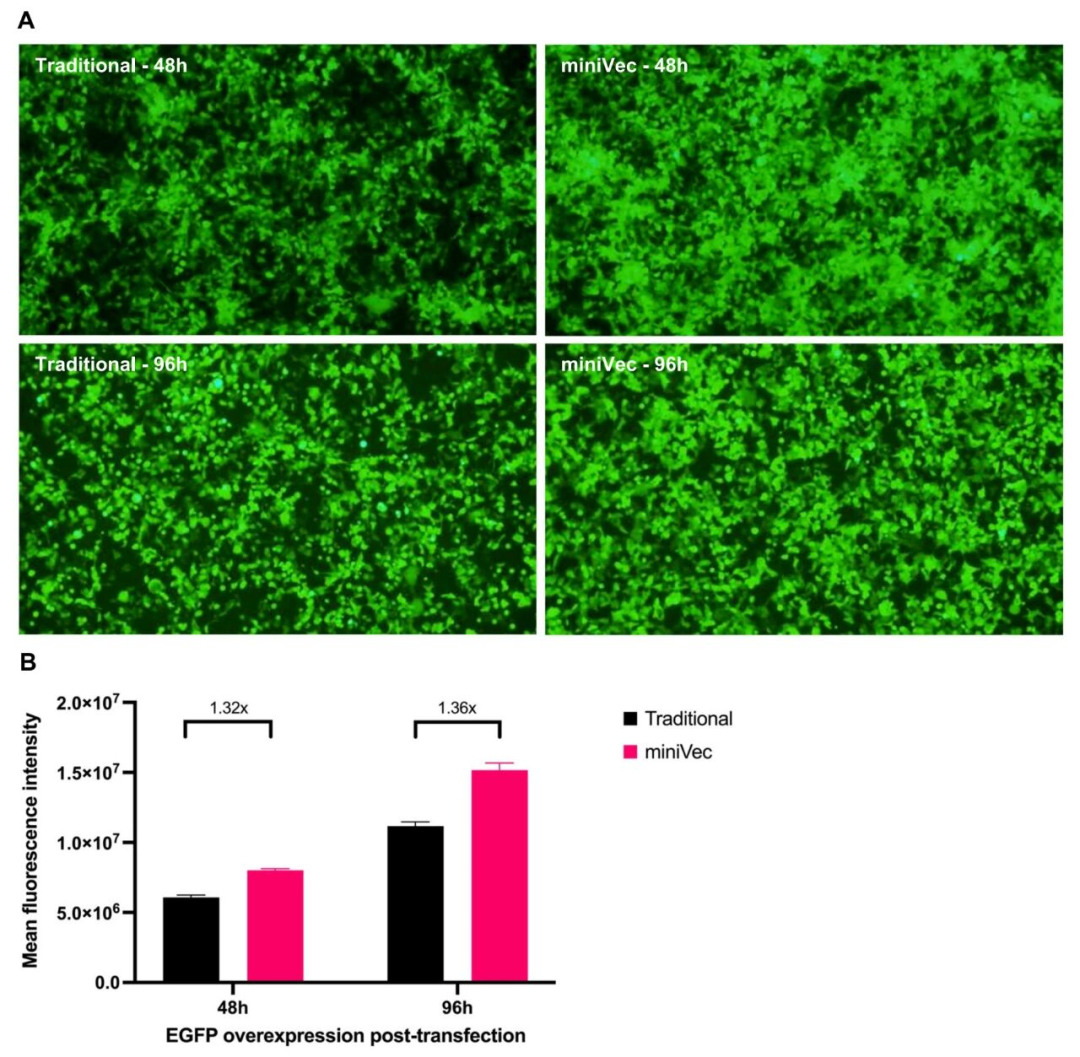
图3 MiniVec™质粒与传统质粒的瞬时转染效率对比
慢病毒包装产量:用4种全为MiniVec™或全为传统骨架的质粒(含携带mCherry报告基因的转移质粒及GagPol、Rev、VSV-G辅助质粒)包装慢病毒,分别转导HEK293T细胞后,荧光成像显示MiniVec™组荧光强度更高。进一步的qPCR分析表明,MiniVec™组的病毒滴度较传统质粒组高出数倍,显示其在慢病毒系统中的显著产量优势。
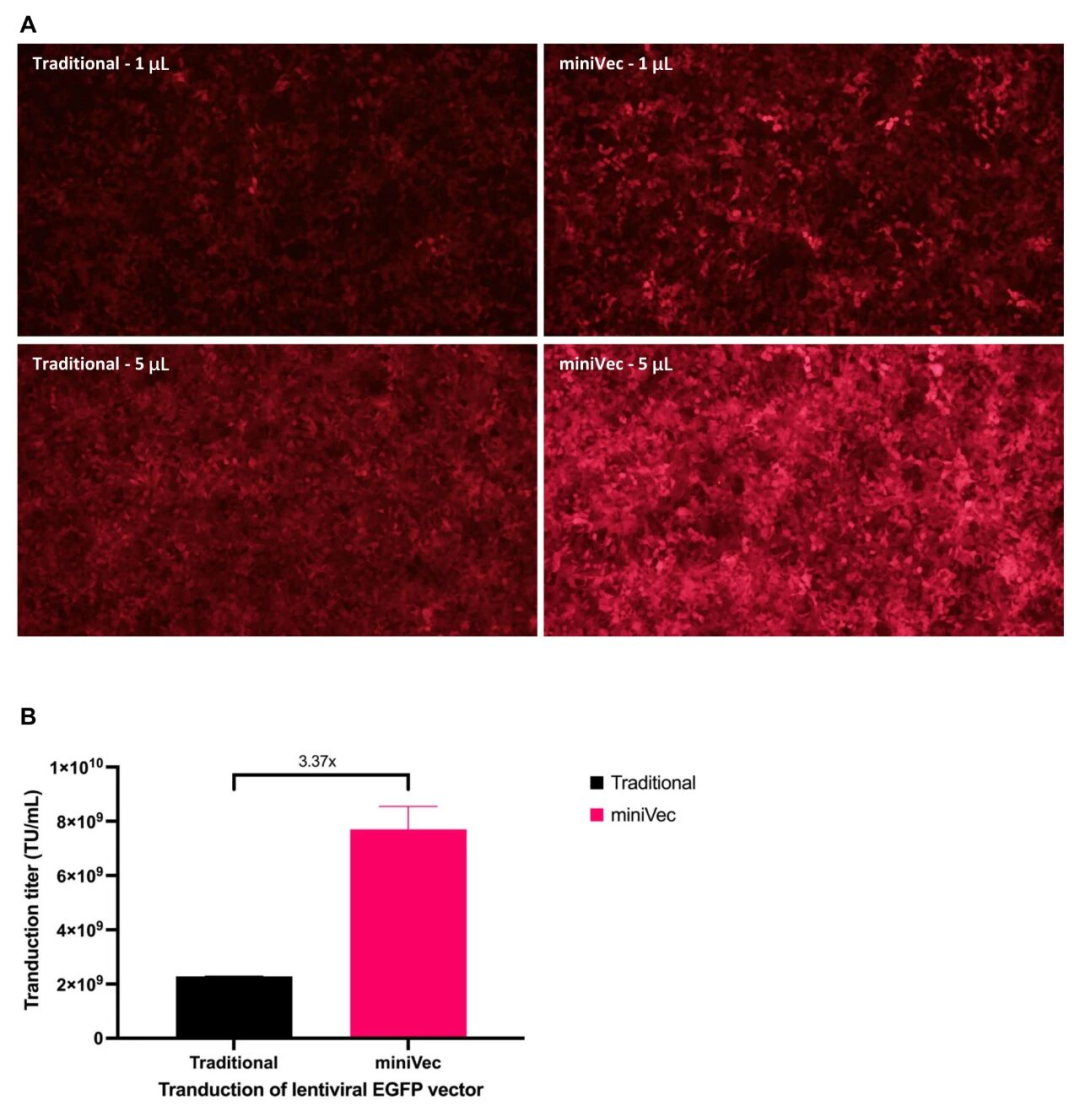
图4 使用MiniVec™质粒与传统质粒包装的慢病毒功能滴度对比
转座子介导的基因组整合:在PiggyBac与Sleeping Beauty系统中,MiniVec™版本的转移与辅助质粒在等摩尔转染条件下产生更高的EGFP荧光水平。由于MiniVec™分子量更小,在等质量转染时整合效率提升更为明显。
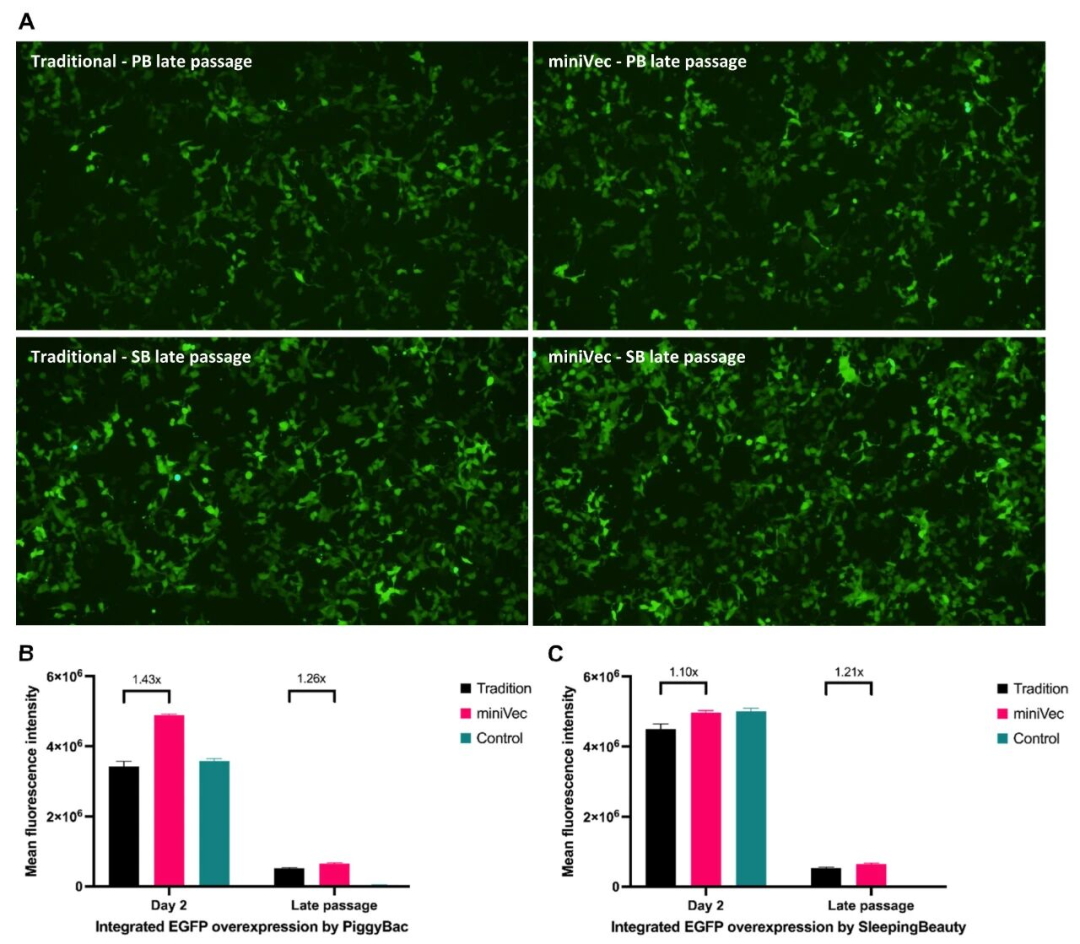
图5 piggyBac(PB)或Sleeping Beauty(SB)转座子系统在 MiniVec™与传统骨架上的转座效率对比
CRISPR介导的基因组整合(HITI):在HEK293T细胞中,以AAVS1位点为靶点,对比MiniVec™与传统骨架的hCas9质粒及EGFP供体质粒。细胞传代至对照组无荧光后,流式分析结果显示MiniVec™组EGFP阳性细胞的荧光强度较传统组提高约78%,表明MiniVec™能显著增强CRISPR-HITI介导的基因组整合效率。
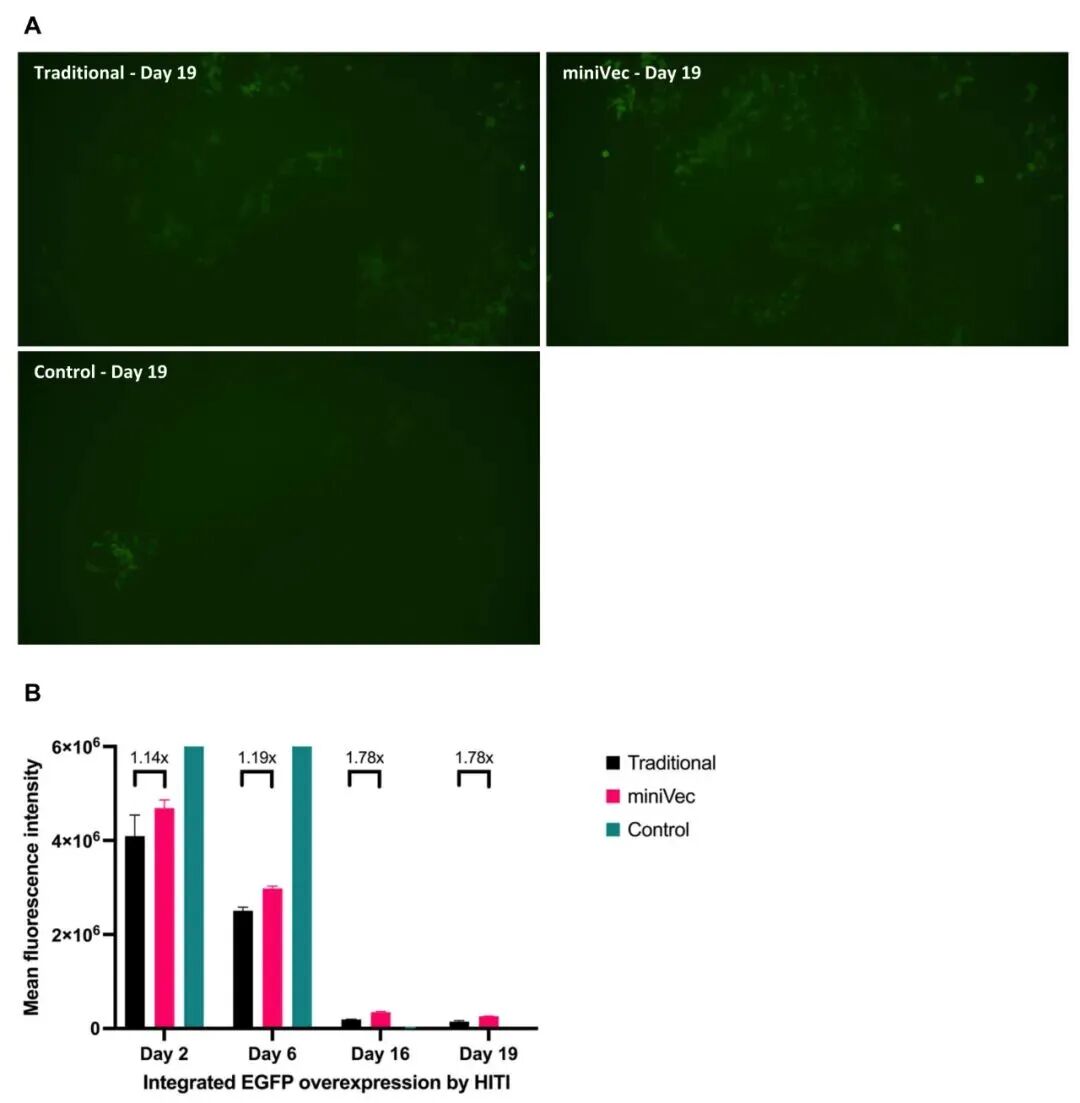
图6 MiniVec™骨架与传统骨架的同源独立靶向插入(HITI)效率对比
体内转染效率:小鼠实验表明,MiniVec™在体内递送中同样展现出明显优势:
• 当小鼠静脉注射等摩尔量、携带荧光素酶基因的质粒后,MiniVec™组肝脏的生物发光信号是传统质粒组的数倍,并可持续检测至第7天;
• 肌肉注射实验中,MiniVec™组在注射部位的生物发光持续至第21天,信号强度显著更高。
这些结果表明,MiniVec™在细胞内外均具备更高的转染与表达效率,为体内基因递送提供了新的载体选择。
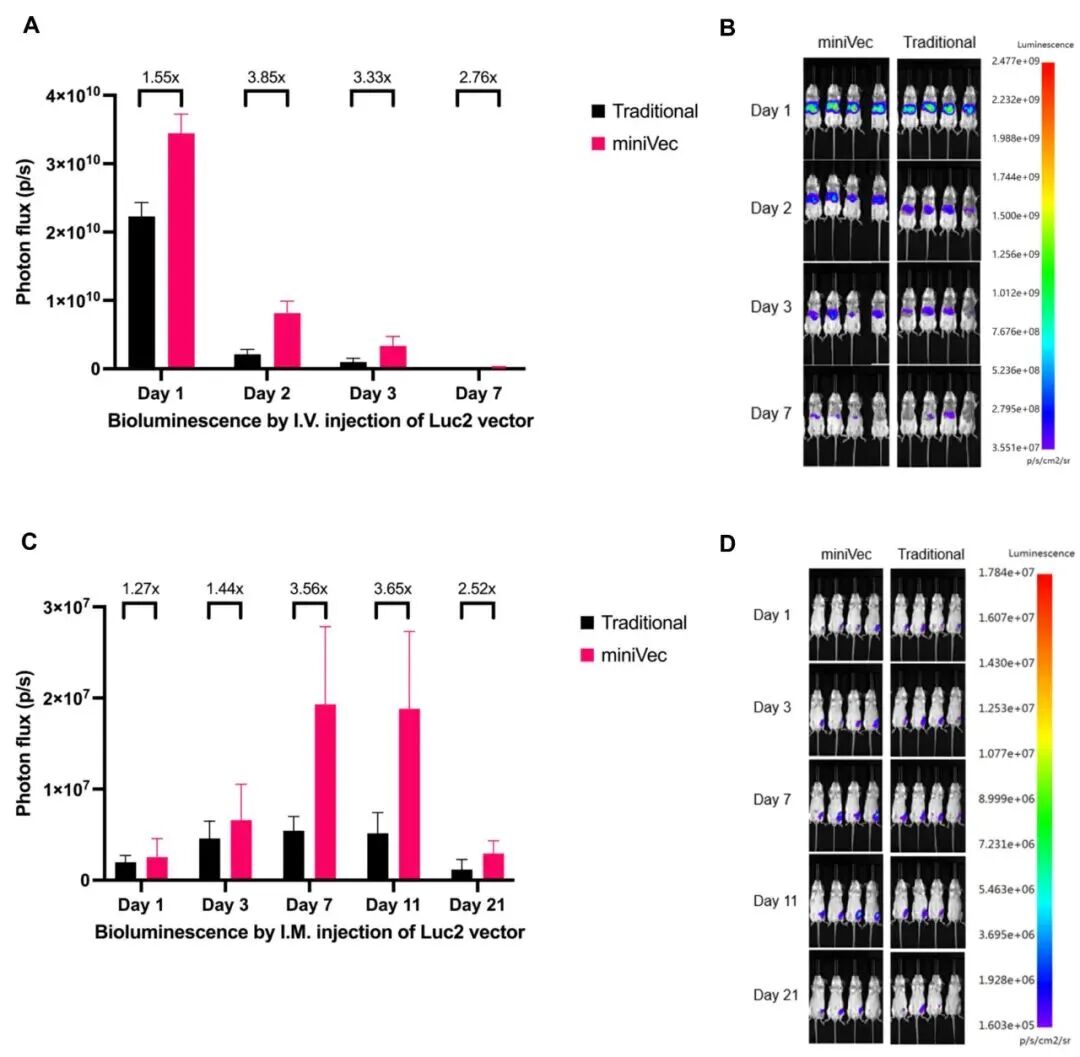
图7 MiniVec™质粒与传统质粒的体内转染效率对比
裸DNA疫苗效果:研究团队以SARS-CoV-2刺突蛋白(S蛋白)基因的质粒为模型,对小鼠进行三次肌肉注射免疫。结果显示:
• ELISA检测表明,MiniVec™组小鼠血清中抗S蛋白IgG抗体滴度显著高于传统质粒组;
• 脾细胞IFN-γ ELISPOT与细胞因子ELISA分析结果显示,MiniVec™组诱导的IFN-γ与IL-2分泌水平均显著提升。
这意味着MiniVec™不仅能增强抗原表达水平,还能有效提升DNA疫苗引发的体液与细胞免疫反应,为疫苗研发提供了一种更具免疫效能的质粒平台。
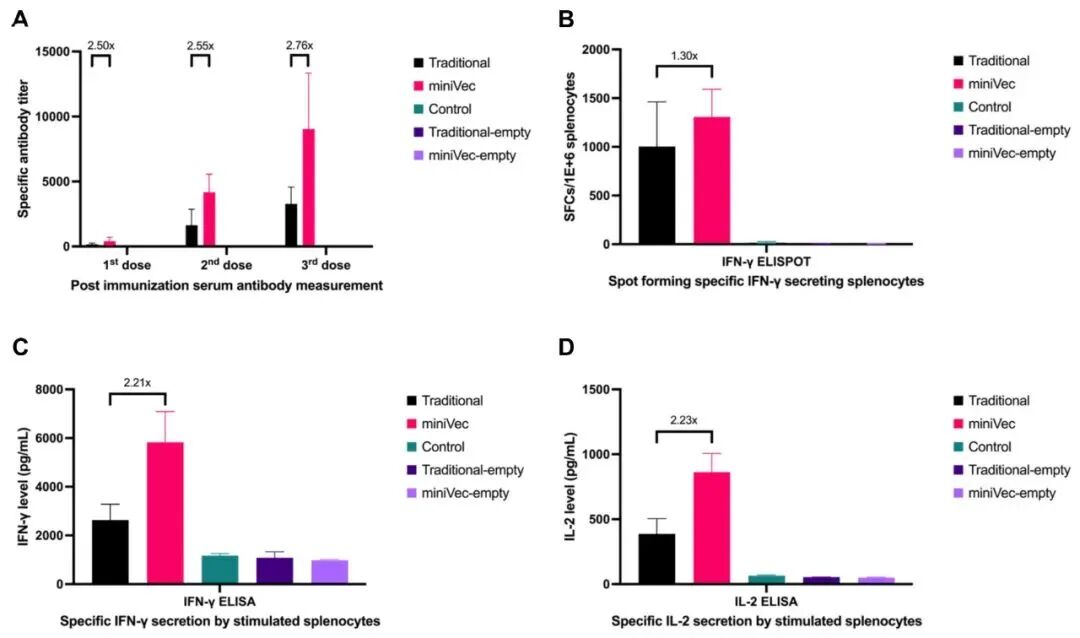
图8 表达SARS-CoV-2刺突蛋白的MiniVec™质粒与传统质粒在裸DNA疫苗免疫中的免疫应答对比
MiniVec™质粒的安全性验证
无免疫原性:注射不含目的基因的空MiniVec™质粒,通过多种免疫检测(细胞因子、抗体水平),未观察到小鼠产生可检测的免疫反应,证明MiniVec™骨架自身无免疫原性。
无毒性:在急性毒性实验中,小鼠单次肌肉注射400μg空MiniVec™质粒,16天内体重、饮食、行为与对照组无差异,无异常症状;
重复毒性实验中,小鼠每周2次注射10μg或50μg空MiniVec™质粒,持续4周,无死亡或不良反应;第28天和第56天检测血液学(红细胞、白细胞、血小板等)、生化学(肝酶、肌酐、尿素等)指标及器官重量系数,均与对照组无显著差异,肝、肾组织病理学检查无炎症或坏死;
而高剂量传统质粒组有1只雄鼠出现肝细胞气球样变性和肾空泡变性,提示MiniVec™在安全性方面具有明显优势。
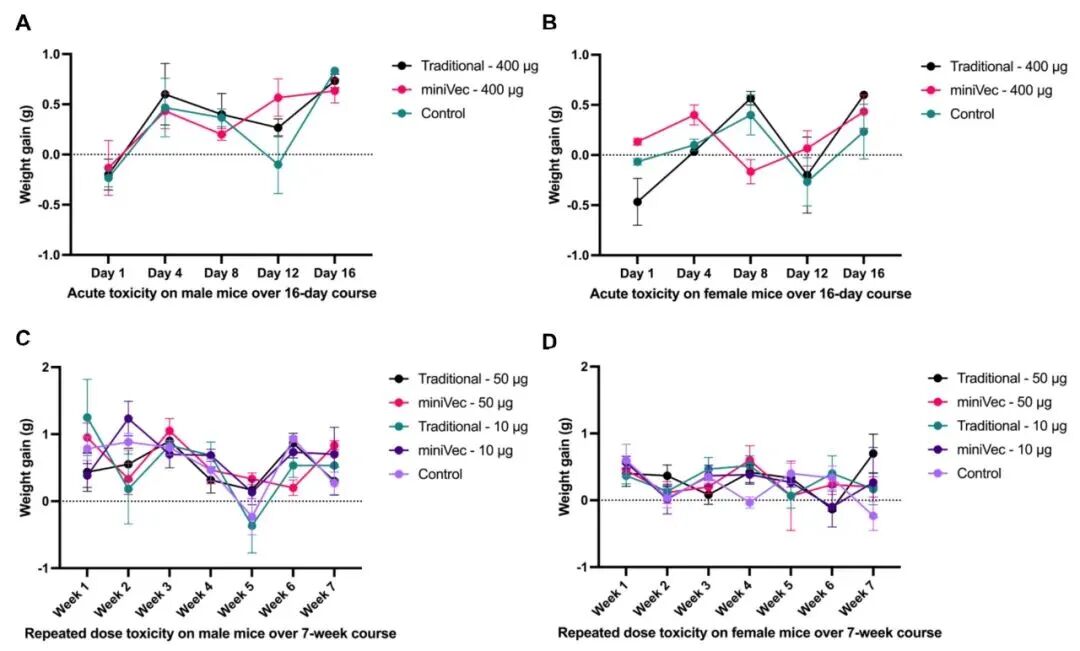
图9 裸质粒DNA给药后小鼠的体重变化
云舟生物与未来基因递送研究院团队的研究系统揭示了MiniVec™微型质粒骨架在克服传统质粒局限方面的突破性意义。通过无抗生素、无化学添加剂、无蛋白质编码序列的极简化设计,MiniVec™显著降低了制造与监管成本,为无抗生素基因载体体系的规模化生产提供了新的解决方案。
这一创新体系不仅消除了传统质粒在抗生素依赖、代谢负担和功能拓展方面的瓶颈,也为基因治疗、DNA疫苗及生物制造等领域提供了更安全、高效且可大规模应用的新一代质粒平台。MiniVec™的提出与验证,为未来质粒设计及应用开辟了新方向。